武汉金开瑞生物工程有限公司品牌商
12 年
手机商铺
- NaN
- 0.5
- 0.5
- 1.5
- 0.5
公司新闻/正文
值得收藏!一文带你全方位了解双分子荧光互补(BiFC)技术(上篇)
1407 人阅读发布时间:2024-08-26 16:07
值得收藏!一文带你全方位了解双分子荧光互补(BiFC)技术(上篇)
蛋白质是生命体的重要组成部分,是生命活动的主要承担者和执行者。据估计,超过80%的蛋白质并不是孤立存在,而是与其他蛋白质通过相互作用形成稳定或瞬时的复合物结构。蛋白质-蛋白质相互作用(protein-protein interactions,PPIs)是分子生物学中最重要的现象之一,几乎在所有的生命过程如信号转导、细胞通讯、代谢、转运、免疫应答和基因转录中都起着关键作用。因此,研究蛋白质-蛋白质相互作用对于阐明蛋白质分子的生物功能以及分子作用机理具有重要的意义。


(1)返还目的基因剩余质粒;
(2)默认做1个阳性对照,3个阴性对照,1个实验组,共5组;
(3)1组阳性对照和3组阴性对照各交付1个视野,实验组交付4-5个视野,每个视野都包含YFP、Bright field、Merge 3张图;
(4)结题报告以及全部原始数据。
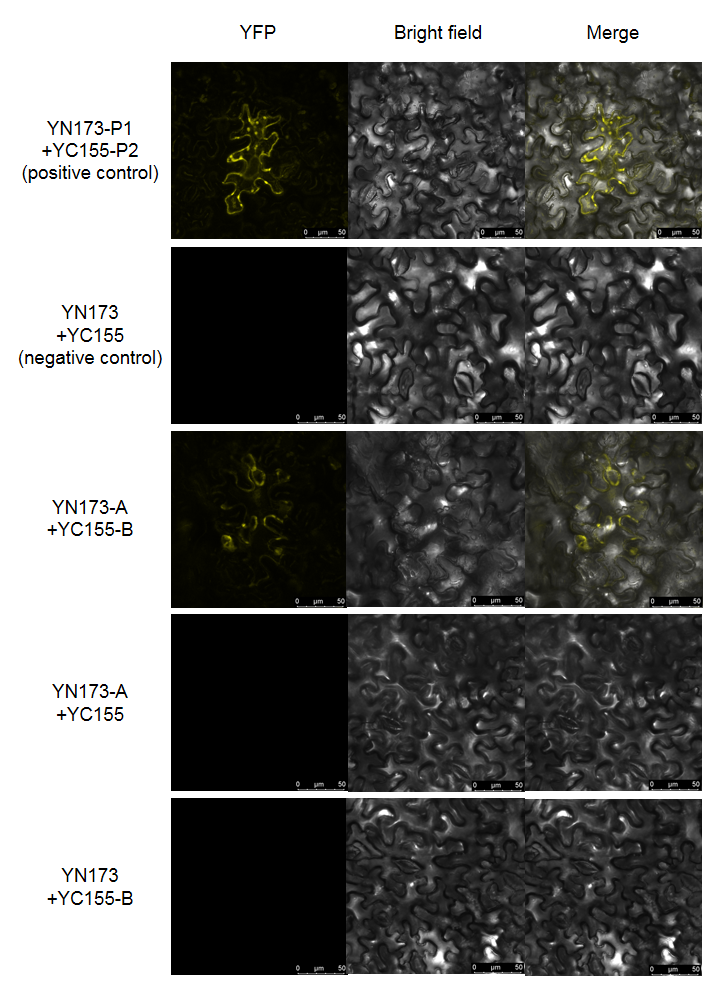
(1)默认分组方式如图所示,每组每个视野都会拍摄荧光、明场以及融合3张照片;
(引自:DOI: 10.1105/tpc.114.123208);
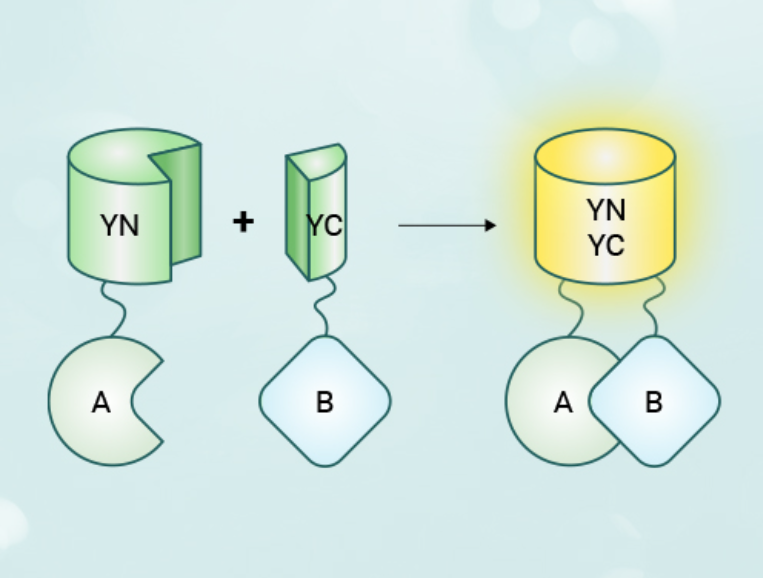
(1)荧光蛋白片段的选择与验证:确保所选荧光蛋白片段(如GFP的N端和C端)在单独表达时不产生荧光,避免假阳性;
(2)融合蛋白的表达:验证融合蛋白(目标蛋白与荧光蛋白片段的融合)在细胞中的正确表达和定位;
(3)转染效率优化:调整转染条件以提高目标细胞内的融合蛋白表达水平,同时减少细胞毒性;
(4)时间控制:精确控制荧光蛋白表达的时间窗口,确保在细胞生理状态下观察PPIs;
(5)荧光观察与成像:使用合适的显微镜和成像设置,清晰捕捉荧光信号,区分真实信号与背景噪声;
(6)对照实验:设立明确的阴性和阳性对照,以区分非特异性结合和真实PPIs;
(7)实验条件一致性:保持每次实验条件(如细胞类型、培养条件、成像参数等)的一致性,以便于结果比较。
为了确保荧光信号的真实性,需要排除假阳性的可能性。假阳性可能是由于荧光蛋白片段的非特异性相互作用或其他非目标蛋白质之间的相互作用引起的。因此,在实验中应设置对照组,如单独表达荧光蛋白片段或目标蛋白的对照组,以排除非特异性相互作用的干扰。此外,还可以结合其他实验方法,如免疫共沉淀(Co-IP)、共定位、酵母杂交等,来进一步验证蛋白质相互作用。
荧光信号较弱可能是由于荧光蛋白片段与目标蛋白的融合效率不高,或者融合蛋白在细胞内的表达量较低。为了优化荧光信号,可以尝试增强启动子,以提高融合蛋白的表达水平。此外,还可以优化转染条件,确保细胞具有较高的转染效率。在制片过程中,应尽可能清理干净叶片表面的杂质,排除气泡,以减少背景干扰。
可能的原因有多种。首先,可能是所研究的蛋白质之间确实不存在相互作用,因此无法形成完整的荧光蛋白。其次,可能是荧光蛋白片段与目标蛋白的融合构建存在问题,导致融合蛋白不能正确表达或折叠。此外,实验条件、细胞状态或转染效率等因素也可能影响荧光信号的检测。针对这种情况,建议重复实验,优化实验条件,并检查融合蛋白的表达情况。