武汉金开瑞生物工程有限公司品牌商
12 年
手机商铺
- NaN
- 0.5
- 0.5
- 1.5
- 0.5
公司新闻/正文
RNA-蛋白互作研究全景解析:从circPOLR2A案例看机制探索之路
38 人阅读发布时间:2025-11-28 10:45
在生命科学的微观世界中,RNA与蛋白质的相互作用是调控基因表达、影响细胞命运的关键环节。从转录后调控到信号转导,从发育生物学到疾病发生,RNA-蛋白互作的研究正成为解析生命机制的重要突破口。
近年来,随着环形RNA(circRNA)、m6A修饰等研究的突破,RNA-蛋白互作的研究方法与技术路径也日益成熟。今天,我们将以一篇发表于顶刊《Molecular Cancer》 的经典研究《Circular RNA circPOLR2A promotes clear cell renal cell carcinoma progression by facilitating the UBE3C-induced ubiquitination of PEBP1 and, thereby, activating the ERK signaling pathway》 为例,系统拆解如何从零开始,揭示其背后的技术逻辑与科学价值,将简单的“结合”关系,升华为一个完整的致病故事。
RNA结合蛋白(RBP)通过与特定RNA结合,调控其稳定性、定位、翻译甚至降解,进而影响细胞功能。在许多疾病中(如癌症、神经退行性疾病),RNA-蛋白互作的异常往往是致病的关键机制之一。
以circPOLR2A在肾透明细胞癌(ccRCC)中的研究为例:该circRNA通过结合UBE3C和PEBP1蛋白,形成三元复合物,促进PEBP1的泛素化降解,从而激活ERK信号通路,推动肿瘤进展。这一机制的揭示,不仅深化了我们对circRNA功能的认识,也为癌症治疗提供了新靶点。
生物信息学分析:通过GEO、TCGA等数据库筛选差异表达的RNA分子。
实验验证:使用qRT-PCR、Northern Blot、RNA-FISH等技术在组织与细胞中验证其表达与定位。
例如,circPOLR2A通过生物信息学筛选并在32对ccRCC组织中验证其高表达。
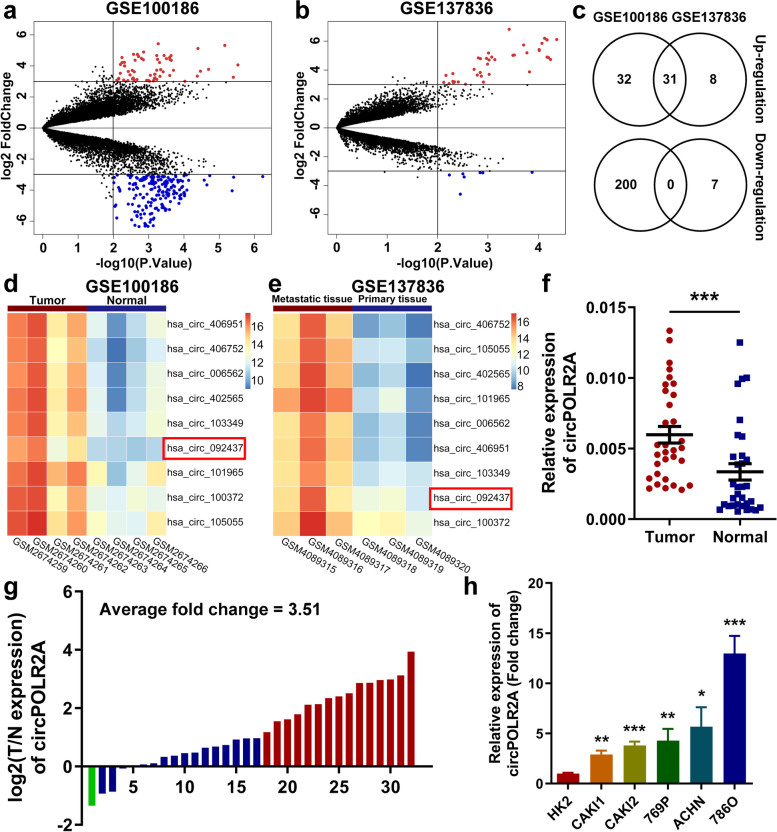
图1.调控异常的环RNA的剖析及cRCC中circPOLR2A异常表达的验证
Sanger测序:展示了circPOLR2A源自POLR2A基因的反向剪接,并通过测序峰图确认了其独特的背接位点(图2a)
RNase R耐受实验:确认circPOLR2A对核酸外切酶的抵抗能力(图2c, d)。
放_线_菌_素_D实验:评估circPOLR2A的半衰期与稳定性(图2e, f)。
定位分析:通过核质分离和RNA荧光原位杂交(FISH),证实circPOLR2A主要定位于细胞质,为其在细胞质中行使蛋白互作功能提供了舞台(图2g-i)。
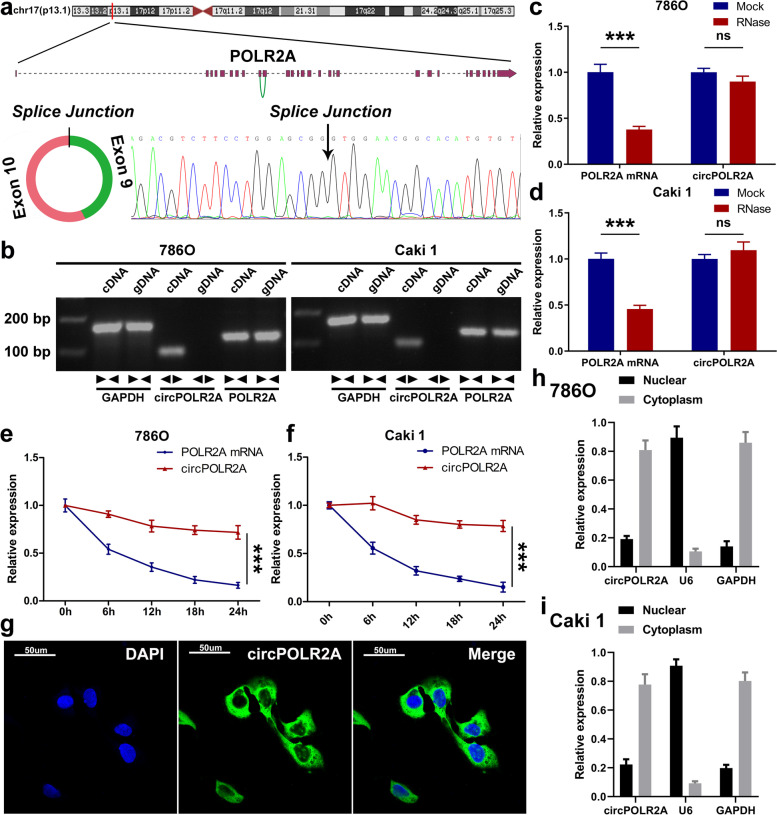
图2.circPOLR2A的特征分析
这是整个研究的核心环节,旨在回答circPOLR2A与哪些蛋白结合?通过“体外” Pull-Down与“体内” RIP相互印证,结合“原位”共定位, 构建了RNA-蛋白互作的铁三角证据链,结论坚实可信。
❖技术组合拳之一:RNA Pull-Down + 质谱分析
方法:设计生物素标记的circPOLR2A特异性探针和阴性对照探针,与细胞裂解液共孵育,拉取与circPOLR2A直接结合的蛋白,然后通过银染和质谱分析进行筛选。
关键结果:
银染图显示有特异性条带被circPOLR2A探针拉下(图3a)。
质谱鉴定出301个候选互作蛋白。通过与临床预后数据库(CPTAC)进行交叉分析,最终锁定PEBP1和UBE3C等关键蛋白进行后续研究(图3b)。
❖技术组合拳之二:RNA免疫共沉淀(RIP)
方法:使用PEBP1或UBE3C的特异性抗体,在细胞内源性环境下捕获与其结合的RNA,再通过qRT-PCR检测circPOLR2A是否被富集。
关键结果:
结果表明,与对照IgG组相比,PEBP1和UBE3C抗体能显著富集circPOLR2A,从反面验证了它们的结合。
❖技术组合拳之三:共定位验证
方法:结合RNA-FISH(标记circRNA)和免疫荧光(标记蛋白),在细胞原位观察它们是否在空间上共存。
关键结果:
清晰的共聚焦图像显示,circPOLR2A(绿色)与PEBP1(红色)在细胞质中完美共定位(黄色信号),为它们的相互作用提供了最直观的证据(图3f)。
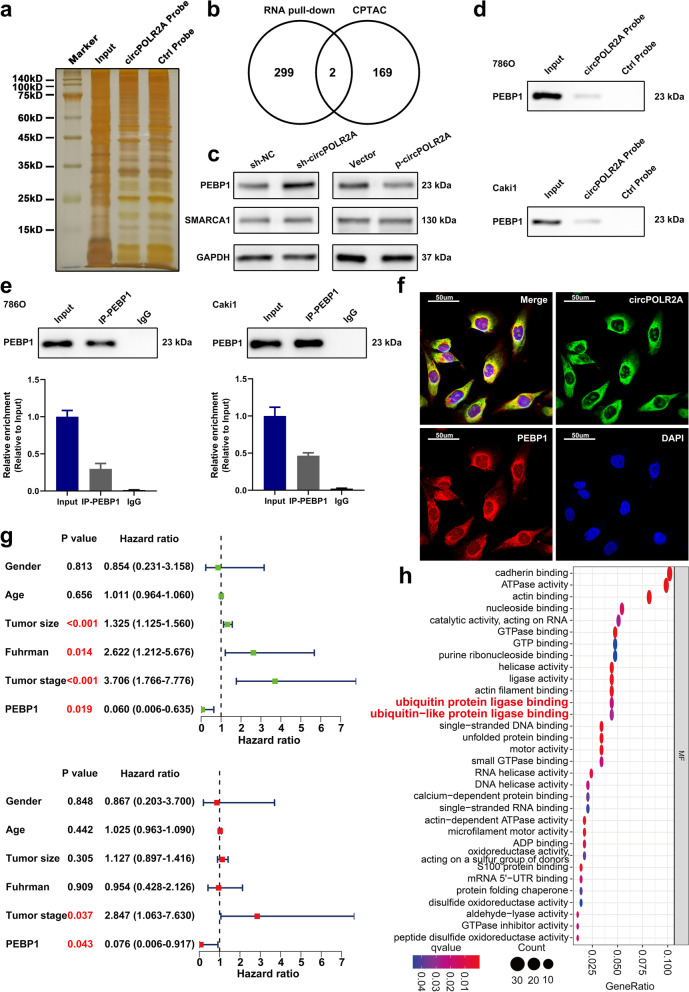
图3.CircPOLR2A可能与PEBP1蛋白相互作用
发现表型:通过体外实验(CCK-8、克隆形成、Transwell、凋亡实验)和体内动物实验,证实circPOLR2A能促进癌细胞增殖、迁移、侵袭,抑制凋亡。
解析机制:
发现泛素-蛋白酶体途径:当使用蛋白酶体抑制剂MG132后,PEBP1的降解被逆转。Co-IP实验进一步证明,circPOLR2A能增强PEBP1的泛素化修饰(图4a-d)。
锁定E3泛素连接酶:研究者从互作蛋白中锁定UBE3C,并通过Co-IP证明UBE3C是直接催化PEBP1泛素化的E3连接酶。
功能回复实验:通过敲低/过表达目标分子(PEBP1),验证其在表型调控中的必要性。
研究发现,circPOLR2A作为“分子支架”增强UBE3C对PEBP1的泛素化降解,激活ERK通路,促进肿瘤恶性行为。
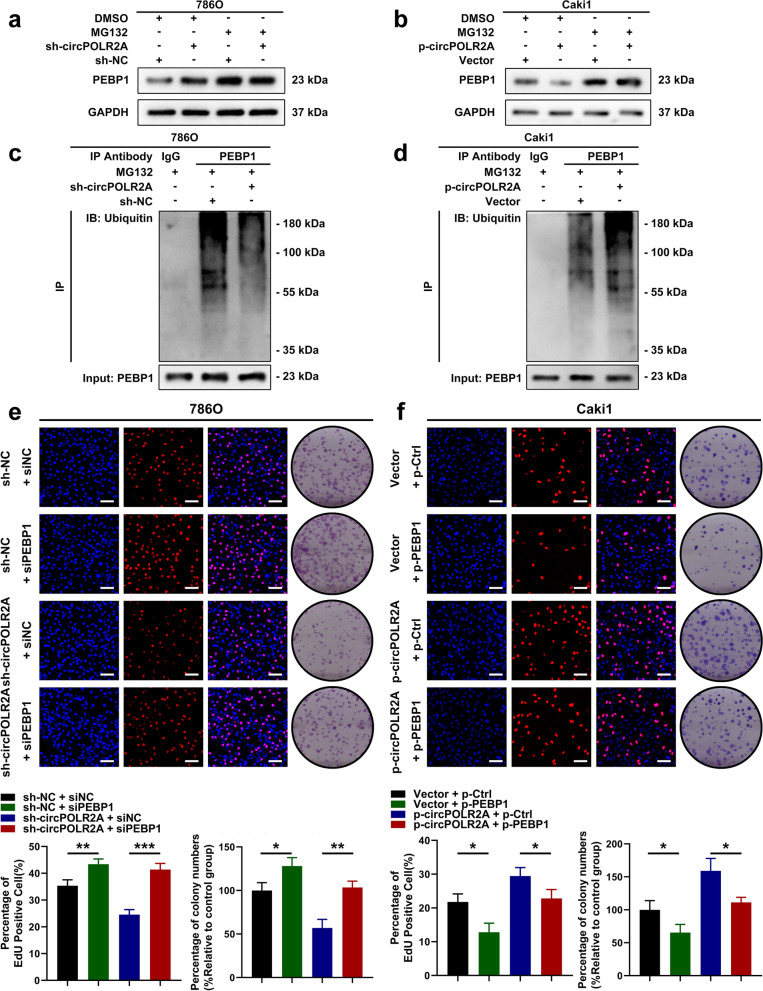
图4. CircPOLR2A加速了PEBP1泛素/蛋白酶体依赖的蛋白质降解
表观转录组学:如m6A修饰分析(MeRIP)揭示RNA修饰对其稳定性或功能的影响。
调控蛋白识别:如YTHDF2作为m6A阅读蛋白,调控circPOLR2A的表达。
研究者发现m6A阅读蛋白YTHDF2能与circPOLR2A结合(图5a-c),并通过MeRIP实验证实circPOLR2A本身存在m6A修饰(图5f)。YTHDF2通过识别m6A修饰来促进circPOLR2A的降解,从而在正常组织中抑制其水平。而在癌症中,YTHDF2的低表达导致了circPOLR2A的积累,开启了整个致癌过程(图5g-k)。
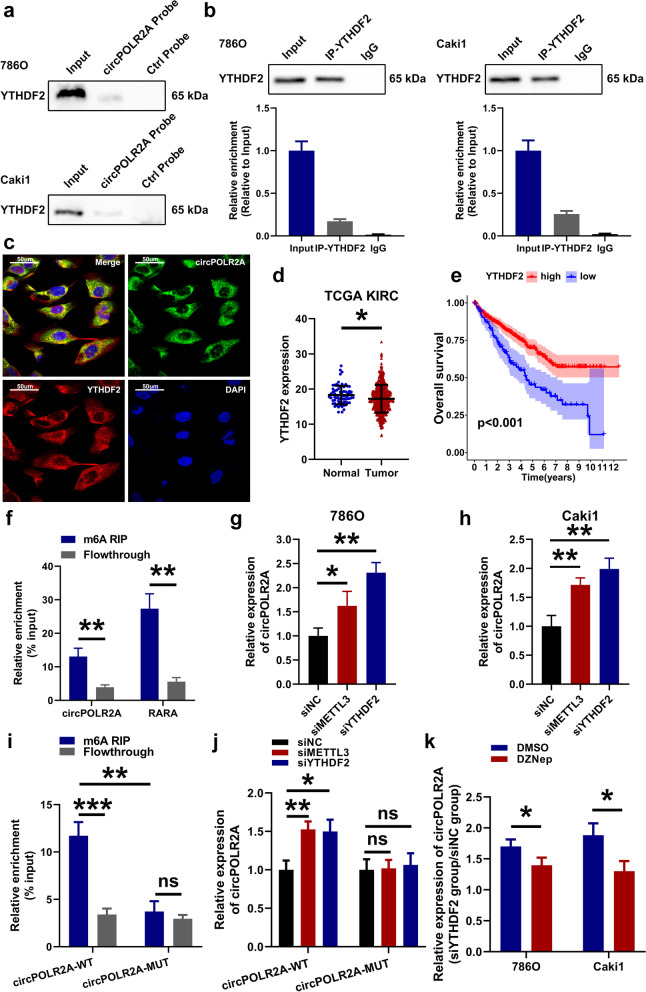
图5 .敲低m6A阅读蛋白YTHDF2促进了cRCC细胞中circPOLR2A的表达
这项研究为我们提供了一个RNA-蛋白互作研究的典范模板:
目标锁定:生信筛选+实验验证。
身份鉴定:环状RNA特性验证。
寻找伙伴:Pull-Down + RIP + 共定位。
机制深挖:表型分析→翻译后调控探索→酶功能确定→“分子支架”模型验证→信号通路贯通。
上游追溯:揭示RNA自身的表观转录调控。
随着新技术不断涌现,对RNA-蛋白互作的研究必将更加深入。它不仅帮助我们理解生命的基本原理,更为攻克癌症等重大疾病提供了无限可能。掌握这套研究范式,你我都能在微观世界的对话中,聆听并解读出下一个关键的生命密码。