武汉金开瑞生物工程有限公司品牌商
12 年
手机商铺
- NaN
- 0.5
- 0.5
- 1.5
- 0.5
公司新闻/正文
【收藏级干货】蛋白互作验证全攻略:从实验设计到顶刊发表
88 人阅读发布时间:2025-11-07 10:44
在分子机制研究中,蛋白互作验证已成为突破文章档次瓶颈的关键一环。这不仅是从2区到1区的跨越捷径,更是转化医学研究的重要基石。今天为大家系统梳理蛋白互作研究的完整技术路线!
1️⃣ 结合验证 - 证明两个分子存在物理相互作用
2️⃣ 靶点定位 - 精确鉴定结合结构域/位点
3️⃣ 功能调控 - 分析结合对分子活性的影响
4️⃣ 表型关联 - 阐明互作下游信号通路与疾病相关性

2024年发表在顶刊《Mol Cancer》的一篇题为“ESM1 enhances fatty acid synthesis and vascular mimicry in ovarian cancer by utilizing the PKM2-dependent warburg effect within the hypoxic tumor microenvironment”文章。主要介绍了ESM1是一种分泌蛋白,在促进卵巢癌(OC)的增殖和血管生成中起着重要作用。然而,ESM1 在 OC 患者缺氧微环境中代谢重编程和 VM 中的作用尚未确定,为了探究ESM1的作用,作者采用了以下方法进行探究:
❖液相色谱联合串联质谱分析CAOV3和OV90细胞。
❖通过GST-pull down、CoIP、IF免疫荧光共同验证ESM1、PKM2、UBA2和SUMO1之间的相互作用。
❖使用分子对接预测 ESM1、PKM2、UBA2 之间的结合位点与相互作用模式。
❖通过肾小管形成、transwell实验、RT-qPCR、Western blot、免疫荧光和体内异种移植肿瘤实验检测信号轴对OC细胞的生物学效应。
结果表明,缺氧通过HIF-1α的转录诱导ESM1表达的上调,ESM1是PKM2 和 UBA2 之间相互作用的重要介质,促进 PKM2 的 SUMO 化和随后PKM2二聚体的形成。这一过程促进了 Warburg 效应并促进了 PKM2 的核易位,最终导致 STAT3 的磷酸化。这有助于促进卵巢癌糖酵解和血管生成模拟。此外,作者的研究表明,Shikonin(紫草素)有效抑制 ESM1 和 PKM2 之间的分子相互作用,从而阻止 PKM2 二聚体的形成,抑制卵巢癌糖酵解、脂肪酸合成和血管生成模拟。
首先进行IP和液相色谱联合串联LC-MS/MS。通过蛋白质组学分析,成功鉴定出CAOV3细胞中共有203种蛋白质作为ESM1特异性结合蛋白,在OV90细胞中鉴定出196种蛋白质。有趣的是,在两种细胞系中发现与 ESM1 相互作用的 159 种蛋白质存在重叠,KEGG分析显示,这159种ESM1特异性结合蛋白大多富集于碳代谢、糖酵解/糖异生、脂质和动脉粥样硬化。与ESM1最强结合能力相关的5种蛋白质是PLEC、PKM2、ENO1、MYH9和HSPD1。
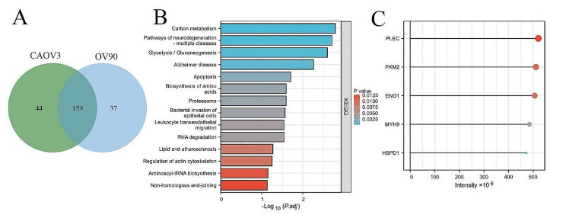
图1.通过蛋白组学分析CAOV3和OV90细胞中ESM1相互作用的蛋白
我们的Co-IP分析表明,内源性ESM1和PKM2在OV90和CAOV3细胞中相互作用(图2A). 正如预期的那样,IF染色证实ESM1和PKM2在这些OC细胞中强烈共定位(图2B)。然后,我们在293T细胞中过表达Flag-ESM1和GST-PKM2,并证实外源性ESM1在293T转染细胞中与PKM2特异性结合(图2C)。接下来使用 IHC 染色来研究 ESM1 和 PKM2 在 OC 患者样本中的表达和位置。这些研究表明,在OC患者样本中,ESM1与PKM2显著相关(P < 0.001,R = 0.74)(图2D)。我们还发现,在TCGA数据库OC数据集中,ESM1 mRNA与PKM2 mRNA显著相关(P = 0.027,R = 0.113)(图2E). 交联PKM2染色显示,与CAOV3和OV90细胞的载体组相比,ESM1过表达组的二聚体PKM2显著增加,与SKOV3和A2780细胞的载体组相比,ESM1敲低组的二聚体PKM2降低(图2F)。
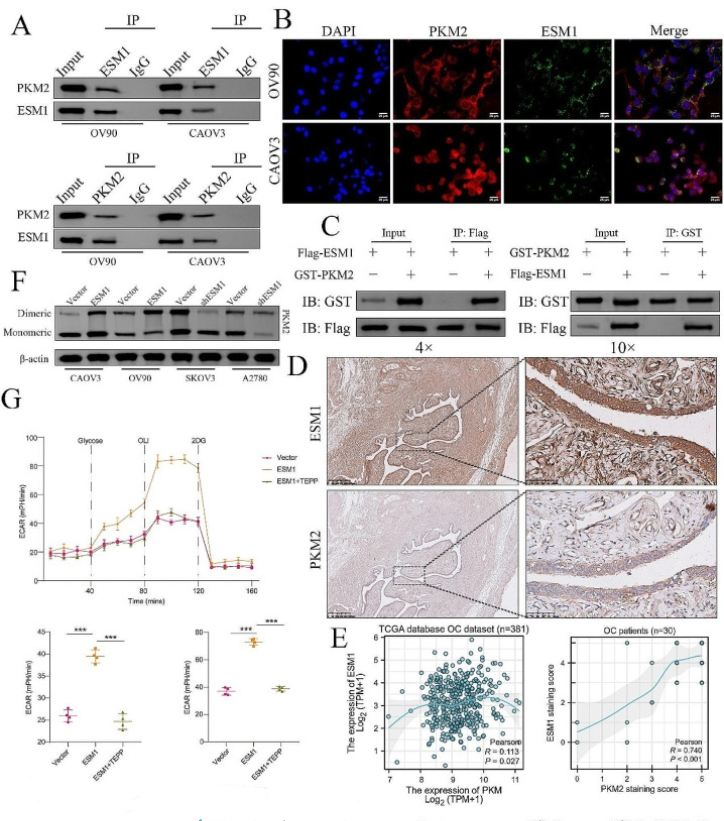
图2.ESM1 通过与 OC 细胞中的 PKM2 相互作用来驱动 Warburg 效应。(A)co-IP测定证实了CAOV3和OV90细胞中ESM1和PKM2之间的相互作用。(B)IF证实了CAOV3和OV90细胞中ESM1和PKM2之间的相互作用。(C)将标记的ESM1和GST标记的PKM2转染到HEK-293T细胞中,然后进行Co-IP。(D)通过IHC染色测定的OC组织样本病理连续切片中ESM1和PKM2的表达(n = 30)。(E) OC 患者中 ESM1 和 PKM2 表达之间的相关性基于 TCGA 数据库 (n = 381)。(F)在具有ESM1敲低或过表达的OC细胞中形成二聚体PKM2。
ESM1分子模型是使用alphafold2构建的,随后,从PDB数据库中获取了UBA2(6XOG)和PKM2(1ZJH)的分子结构模型。采用GalaxyWEB对接软件(galaxy.seoklab.org/c)进行蛋白质-蛋白质对接,最终通过PyMOL映射分析选择最佳对接组合。ESM1中的8个残基LEU81、ASP27、ASP50、ASP90、GLY88、ARG82、LYS100和GLU303被预测为结合区的关键。这些数据还表明,ESM1、PKM2和UBA2之间的相互作用可能对ESM1的分子功能至关重要。
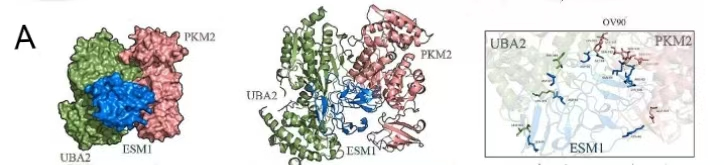
图3.HADDOCK对UBA2、PKM2和ESM1进行分子对接分析
在CAOV3和OV90细胞中,与ESM1过表达组相比,ESM1和紫草素组的乳酸水平显著降低。相反,与ESM1过表达组相比,ESM1和紫草素组的葡萄糖水平显著升高(图4D)。功能实验表明,紫草素减弱了 ESM1 对 CAOV3 和 OV90 细胞迁移、侵袭和 VM 能力的影响(图 4E&F)。这些结果表明,紫草素可以通过体外驱动Warburg效应来抑制PKM2和ESM1之间的相互作用以及PKM2二聚体的形成,从而减弱OC迁移和侵袭以及VM。
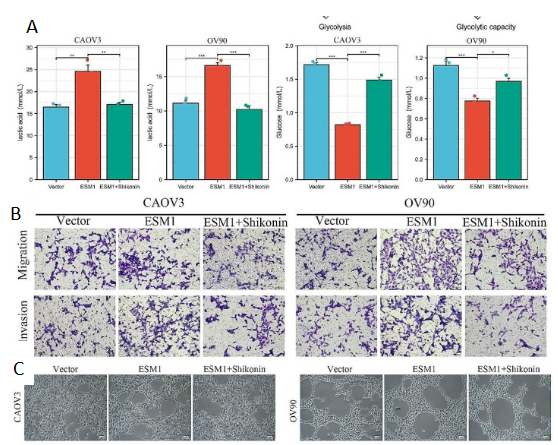
图4. Shikonin 通过在体外抑制 ESM1 与 PKM2 的结合来抑制 OC 细胞 VM 和糖
该文章在蛋白互作探究中的核心优势在于,它并未停留在简单的结合验证层面,而是通过多技术联用(Co-IP、GST Pull-down、质谱、分子对接等),构建了一个从发现、验证到功能阐释的完整证据链;尤为突出的是,它深入揭示了ESM1作为“分子桥梁”促进PKM2发生SUMO化修饰这一关键功能性后果,并巧妙运用点突变和多种小分子抑制剂进行反向遗传和药理学干预,最终将ESM1-PKM2-UBA2这一互作网络与下游的Warburg效应、STAT3信号通路的激活以及血管生成拟态等关键肿瘤恶性表型完美地联系起来,展现了从分子互作到生物学功能的深度挖掘。
在分子机制研究中,采用多技术联合的策略能构建出无可辩驳的证据闭环,极大地提升发现的可靠性,所以深入学习并掌握这套完整的蛋白互作验证体系,不仅能显著提升论文的机制研究深度,更为药物靶点开发和临床转化提供坚实理论基础!