公司新闻/正文
知无不“研”|一文读懂酵母单/双杂交点对点验证
人阅读 发布时间:2020-08-10 10:16
一、前言
酵母双杂交由Fields和Song在1989年提出. 他的产生是基于对真核细胞转录因子特别是酵母转录因子GAL4性质的研究。酵母双杂交就是基因转录所需的转录因子的两个结构域在两个互作蛋白的吸引下位置靠近,诱导了基因的表达。
酵母双杂交系统的最主要的应用是快速、直接分析已知蛋白之间的相互作用,及分离新的与已知蛋白作用的配体及其编码基因。酵母双杂交系统检测蛋白之间的相互作用具有以下优点:
二、酵母单/双杂交简介
1、酵母单杂交
酵母单杂交技术是在酵母双杂基础上发展而来的一种研究核酸-蛋白相互作用的工具,被广泛用于研究真核细胞内基因的表达调控,如鉴别DNA结合位点发现潜在的结合蛋白基因、分析DNA结合结构域信息等。

2、酵母双杂交
酵母双杂交及系统是一种鉴定和检测蛋白质相互作用的研究方法,因其具有灵敏性高、功能强大、适用范围广等特点,现已被应用于多个研究领域。
①核蛋白酵母双杂交:
核蛋白酵母双杂交技术最初由Fields等人在研究酵母转录因子GAL4性质时建立,后续经过不断改进已发展成为一种成熟的蛋白-蛋白互作研究工具,具有简便、灵敏、可反映蛋白在活细胞内互作真实情况的特点,被广泛应用于互作蛋白的筛选、蛋白相互作用的鉴定/验证、蛋白互作机理的探究、蛋白连锁图谱绘制等工作。

②膜蛋白酵母双杂交:
DUALmembrane技术在传统的酵母双杂交系统的基础上,巧妙地利用分离的泛素系统(split-ubiquitin)进行蛋白质相互作用的筛选;泛素作为降解信号分子,人为分成两部分:N端(Nub),C端(Cub),互补重构的完整泛素分子可被泛素专一性蛋白酶(UBPs)识别,从而导致与泛素相连的蛋白被酶解。

三、核酵母单/双杂交点对点验证流程简介及图片分析
A为诱饵,B为猎物。
筛选涉及到的报告基因:
(1)HIS3。
(2)ADE2。
(3)MEL1。
诱饵质粒PGBKT7携带trp基因, , 猎物质粒PGADT7携带Leu基因。
筛选涉及到的平板:DDO[SD/-Leu/-Trp],DDO/X[SD/-Leu/-Trp/X-α-gal],TDO /X [SD/-Leu/-Trp/HIS3/X-α-gal],QDO /X[SD/-Leu/-Trp/HIS3/Ade2/X-α-gal]
1、诱饵自激活验证
 分析:诱饵质粒重组质粒PGBKT7-A和猎物空载PGADT7共转化Y2Hgold酵母菌株。(1)涂布DDO平板能够生长,说明诱饵PGBKT7-A+ PGADT7已成功转入宿主菌中且对宿主菌无毒性;(2)涂布TDO平板,不能生长,说明诱饵PGBKT7-A+ PGADT7无自激活现象,不能激活宿主菌报告基因his的表达;(3)涂布QDO平板没长,说明诱饵PGBKT7-A+ PGADT7无自激活现象,没有激活报告基因ADE2。
分析:诱饵质粒重组质粒PGBKT7-A和猎物空载PGADT7共转化Y2Hgold酵母菌株。(1)涂布DDO平板能够生长,说明诱饵PGBKT7-A+ PGADT7已成功转入宿主菌中且对宿主菌无毒性;(2)涂布TDO平板,不能生长,说明诱饵PGBKT7-A+ PGADT7无自激活现象,不能激活宿主菌报告基因his的表达;(3)涂布QDO平板没长,说明诱饵PGBKT7-A+ PGADT7无自激活现象,没有激活报告基因ADE2。
2、共转验证——阴阳性对照

3、共转验证——实验组
 分析:诱饵重组质粒PGBKT7-A和猎物重组PGADT7-B共转化Y2Hgold酵母菌株。(1)涂布DDO平板能够生长,说明诱饵PGBKT7-A+ PGADT7-B已成功转入宿主菌中且对宿主菌无毒性;(2)涂布TDO平板能生长,说明诱饵PGBKT7-A+ PGADT7-B能够互作,激活了宿主菌报告基因HIS3的表达;(3)涂布QDO平板能长,说明诱饵PGBKT7-A+ PGADT7-B能够互作,同时激活了报告基因HIS3和ADE2的表达。
分析:诱饵重组质粒PGBKT7-A和猎物重组PGADT7-B共转化Y2Hgold酵母菌株。(1)涂布DDO平板能够生长,说明诱饵PGBKT7-A+ PGADT7-B已成功转入宿主菌中且对宿主菌无毒性;(2)涂布TDO平板能生长,说明诱饵PGBKT7-A+ PGADT7-B能够互作,激活了宿主菌报告基因HIS3的表达;(3)涂布QDO平板能长,说明诱饵PGBKT7-A+ PGADT7-B能够互作,同时激活了报告基因HIS3和ADE2的表达。
4、双杂点种图

 1自激活: Y2H[PGBKT7-A+ PGADT7]
1自激活: Y2H[PGBKT7-A+ PGADT7]
2实验组: Y2H[PGBKT7-A+ PGADT7-B]
3阳性对照: Y2H[pGBKT7-53+pGADT7-T]
4阴性对照: Y2H[pGBKT7-lam+pGADT7-T]
5、酵母单杂点对点验证示意图
P为诱饵启动子,B为猎物。
单杂筛选报告和抗性基因:
AbAr/ AUR-C,AUR1基因的一个显性突变版本,编码肌醇磷酸化神经酰胺syn- thase酶。AUR1-C在Y2HGold/ Y1HGold酵母株中表达,是由于蛋白质与蛋白质的相互作用,使GAL4转录激活和DNA结合域接近。可以添加ABA进行背景抑制。,
诱饵质粒PABAI携带Ura基因,猎物质粒PGADT7携带Leu基因。
筛选所用到的平板:SD/- Leu,SD/- Leu/+AbA
 自激活结果分析:PGADT7空载转化含诱饵启动子PAbAi-PY1Hgold酵母菌株。
自激活结果分析:PGADT7空载转化含诱饵启动子PAbAi-PY1Hgold酵母菌株。
(1)涂布SD/-Leu平板能够生长,说明诱饵PAbAi-P已成功转入宿主菌中且对宿主菌无毒性;
(2)涂布SD/-Leu/AbA(100ng/ml), SD/-Leu/AbA(200ng/ml) 平板能生长,说明200ng/ml的AbA不能抑制报告基因AbAr/ AUR-C ;
(3)涂布SD/-Leu/AbA(500ng/ml) ,SD/-Leu/AbA(800ng/ml),SD/-Leu/AbA(1000ng/ml)平板没长,说明能够抑制报告基因AUR1-C的最低AbA浓度为500ng/ml,后续可用AbA(500ng/ml)进行共转验证。如果AbA最高抑制浓度1000ng/ml仍然能够生长,则只能考虑截短诱饵启动子。
6、共转验证——阴阳性对照

7、共转验证——实验组
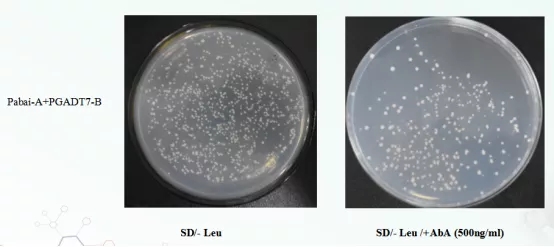 分析:诱饵启动子重组质粒PAbAi-P转化Y1Hgold酵母菌株涂布SD/-Ura平板,挑取单克隆菌制备成感受态,将猎物重组质粒PGADT7-B转化到Y1Hgold【 PAbAi-P 】中。(1)涂布SD/- Leu平板能够生长,说明猎物重组质粒PGADT7-B已成功转入宿主菌中且对宿主菌无毒性;(2)涂布SD/- Leu /+AbA (500ng/ml)平板能生长,说明诱饵PAbAi-P + PGADT7-B能够互作,激活了宿主菌报告基因AbAr/ AUR-C的表达。
分析:诱饵启动子重组质粒PAbAi-P转化Y1Hgold酵母菌株涂布SD/-Ura平板,挑取单克隆菌制备成感受态,将猎物重组质粒PGADT7-B转化到Y1Hgold【 PAbAi-P 】中。(1)涂布SD/- Leu平板能够生长,说明猎物重组质粒PGADT7-B已成功转入宿主菌中且对宿主菌无毒性;(2)涂布SD/- Leu /+AbA (500ng/ml)平板能生长,说明诱饵PAbAi-P + PGADT7-B能够互作,激活了宿主菌报告基因AbAr/ AUR-C的表达。
8、单杂稀释点种图
 更多参考案例:
更多参考案例:
1、Construction and characterization of a high-quality cDNA library of Cymbidium faberi suitable for yeast one- and twohybrid assays.
2、SlAREB1 transcriptional activation of NOR is involved in abscisic acid-modulated ethylene biosynthesis during tomato fruit ripening.
四、金开瑞核蛋白酵母杂交点对点验证简介

五、酵母单/双杂点对点技术优势:
1. 转化效率高,较少假阴性;
2. 设置严格的对照实验,排除假阳性和假阴性;
3. 酵母双杂系统采用多个报告基因,且每个报告基因上游调控区各不相同,可大幅度减少假阳性;
4. 报告基因整合到染色体上,使基因表达水平稳定,消除了由于质粒拷贝数变化引起基因表达水平波动而造成的假阳性;
5. 严格设置点种验证实验菌体生长状态,进一步验证是否互作及互作强弱;
6. 严格保存原始实验数据便于溯源。
六、限时五折

七、常见Q&A
1、哪些网站可以预测蛋白间互作,能把网址分享下吗?
答:http://domine.utdallas.edu/cgi-bin/Domine
https://string-db.org/cgi/input.pl?sessionId=ksdvF3MraTE8&input_page_active_form=single_sequence
2、关于膜蛋白的筛选,如何能提高效率和保证准确度,降低假阳性率?
答:膜蛋白的筛选是采用共转化的方式进行的,筛选的假阳性率相对核蛋白的mating方式筛选假阳性率要低一些,但是共转化筛选对转化效率有要求,不然会产生假阴性。如果采用化学转化对感受态转化效率有一定的要求,至少达到10的4次方,感受态细胞的溶氧的提到(装液量不超过1/5)对感受态的效率提高有帮助。电转化感受态保存10%的甘油,转化参数800v,15m转化效率可以到10的5次方到6次方
3、酵母双杂交过程需要注意的问题与细节?
答:筛选环节控制染菌可以用kan控制细菌染菌;共转化想办法提高转化效率;自激活筛选压力设置梯度尽量跨度减少,保证筛选阳性率的同时避免假阴性的产生。
4、膜蛋白筛选,构建文库复杂吗?
答:膜蛋白和核蛋白文库构建再流程上多了均一化推荐处理,其他的流程基本一样。
5、在用pGADT7和pGBKT7共转验证点对点互作时,AH109和Y2HGold菌株可以通用吗?
答:可以通用
6、膜系统功能验证是怎么做?
答:NMY51(PBT3-N-bait+post1-NubaI)此为功能验证组,NubaI为野生型的ubiquitin的N端结构,保留了原始的三个I氨基酸结构,可以在不需要两个蛋白产生相互作用的情况下两个C端和N端的ubiquitin结构域结合在一起产生具有功能的ubiquitin,从而激活下游的报告基因。结论:在二缺平板上正常生长,说明共转化成功,在三缺和四缺平板上能正常生长,说明我们的bait构建的读码框正确(也就是我们构建的诱饵扩谱结构可以满足筛选的需要)。并我们的ubiquitin系统是存在功能的。
7、请问一下,如何选择酵母双杂交的筛选方法共转法和mating法?
答:共转法筛选假阳性率,但是对转化效率有要求。转化效率太低可能会产生假阴性;mating筛选效率高一些,但是相应的假阳性率相对高些。
8、利用去除激活域的转录因子X作为诱饵,筛选到互作蛋白Y。再利用X的全长蛋白导入AD载体,Y导入BD载体,共转AH109的结果显示不互作。怎么解析?
答:这个问题可以从两个方便分析:1.确保第一次共转化验证是否是阳性,用Y2H菌株替换AH109试试,AH109菌株相对更容易产生假阳性;2.确保初次验证是阳性结果,第二次验证是阴性结果,猜测可能是融合的相应的BD和AD的结构域蛋白包裹了诱饵或者猎物蛋白结构域,因为酵母表达系统是真核系统,表达的蛋白是具有结构的非线性的构象,如果蛋白分子量不大,可以采用诱饵和猎物蛋白两次串联方式的构建,或者某个重要结构域重复串联。
9、请给个预测靶蛋白的网站吗,植物的?
答:https://www.uniprot.org/blast/

酵母双杂交由Fields和Song在1989年提出. 他的产生是基于对真核细胞转录因子特别是酵母转录因子GAL4性质的研究。酵母双杂交就是基因转录所需的转录因子的两个结构域在两个互作蛋白的吸引下位置靠近,诱导了基因的表达。
酵母双杂交系统的最主要的应用是快速、直接分析已知蛋白之间的相互作用,及分离新的与已知蛋白作用的配体及其编码基因。酵母双杂交系统检测蛋白之间的相互作用具有以下优点:
- ⑴ 作用信号是在融合基因表达后, 在细胞内重建转录因子的作用而给出的, 省去了纯化蛋白质的繁琐步骤。
- ⑵ 检测在活细胞内进行, 可以在一定程度上代表细胞内的真实情况。
- ⑶ 检测的结果可以是基因表达产物的积累效应, 因而可检测存在于蛋白质之间的微弱的或暂时的相互作用。
- ⑷ 酵母双杂交系统可采用不同组织、器官、细胞类型和分化时期材料构建cDNA文库, 能分析细胞浆、细胞核及膜结合蛋白等多种不同亚细胞部位及功能的蛋白。
二、酵母单/双杂交简介
1、酵母单杂交
酵母单杂交技术是在酵母双杂基础上发展而来的一种研究核酸-蛋白相互作用的工具,被广泛用于研究真核细胞内基因的表达调控,如鉴别DNA结合位点发现潜在的结合蛋白基因、分析DNA结合结构域信息等。

2、酵母双杂交
酵母双杂交及系统是一种鉴定和检测蛋白质相互作用的研究方法,因其具有灵敏性高、功能强大、适用范围广等特点,现已被应用于多个研究领域。
①核蛋白酵母双杂交:
核蛋白酵母双杂交技术最初由Fields等人在研究酵母转录因子GAL4性质时建立,后续经过不断改进已发展成为一种成熟的蛋白-蛋白互作研究工具,具有简便、灵敏、可反映蛋白在活细胞内互作真实情况的特点,被广泛应用于互作蛋白的筛选、蛋白相互作用的鉴定/验证、蛋白互作机理的探究、蛋白连锁图谱绘制等工作。

②膜蛋白酵母双杂交:
DUALmembrane技术在传统的酵母双杂交系统的基础上,巧妙地利用分离的泛素系统(split-ubiquitin)进行蛋白质相互作用的筛选;泛素作为降解信号分子,人为分成两部分:N端(Nub),C端(Cub),互补重构的完整泛素分子可被泛素专一性蛋白酶(UBPs)识别,从而导致与泛素相连的蛋白被酶解。

三、核酵母单/双杂交点对点验证流程简介及图片分析
A为诱饵,B为猎物。
筛选涉及到的报告基因:
(1)HIS3。
(2)ADE2。
(3)MEL1。
诱饵质粒PGBKT7携带trp基因, , 猎物质粒PGADT7携带Leu基因。
筛选涉及到的平板:DDO[SD/-Leu/-Trp],DDO/X[SD/-Leu/-Trp/X-α-gal],TDO /X [SD/-Leu/-Trp/HIS3/X-α-gal],QDO /X[SD/-Leu/-Trp/HIS3/Ade2/X-α-gal]
1、诱饵自激活验证

2、共转验证——阴阳性对照

3、共转验证——实验组

4、双杂点种图


2实验组: Y2H[PGBKT7-A+ PGADT7-B]
3阳性对照: Y2H[pGBKT7-53+pGADT7-T]
4阴性对照: Y2H[pGBKT7-lam+pGADT7-T]
5、酵母单杂点对点验证示意图
P为诱饵启动子,B为猎物。
单杂筛选报告和抗性基因:
AbAr/ AUR-C,AUR1基因的一个显性突变版本,编码肌醇磷酸化神经酰胺syn- thase酶。AUR1-C在Y2HGold/ Y1HGold酵母株中表达,是由于蛋白质与蛋白质的相互作用,使GAL4转录激活和DNA结合域接近。可以添加ABA进行背景抑制。,
诱饵质粒PABAI携带Ura基因,猎物质粒PGADT7携带Leu基因。
筛选所用到的平板:SD/- Leu,SD/- Leu/+AbA

(1)涂布SD/-Leu平板能够生长,说明诱饵PAbAi-P已成功转入宿主菌中且对宿主菌无毒性;
(2)涂布SD/-Leu/AbA(100ng/ml), SD/-Leu/AbA(200ng/ml) 平板能生长,说明200ng/ml的AbA不能抑制报告基因AbAr/ AUR-C ;
(3)涂布SD/-Leu/AbA(500ng/ml) ,SD/-Leu/AbA(800ng/ml),SD/-Leu/AbA(1000ng/ml)平板没长,说明能够抑制报告基因AUR1-C的最低AbA浓度为500ng/ml,后续可用AbA(500ng/ml)进行共转验证。如果AbA最高抑制浓度1000ng/ml仍然能够生长,则只能考虑截短诱饵启动子。
6、共转验证——阴阳性对照

7、共转验证——实验组

8、单杂稀释点种图

1、Construction and characterization of a high-quality cDNA library of Cymbidium faberi suitable for yeast one- and twohybrid assays.
2、SlAREB1 transcriptional activation of NOR is involved in abscisic acid-modulated ethylene biosynthesis during tomato fruit ripening.
四、金开瑞核蛋白酵母杂交点对点验证简介

五、酵母单/双杂点对点技术优势:
1. 转化效率高,较少假阴性;
2. 设置严格的对照实验,排除假阳性和假阴性;
3. 酵母双杂系统采用多个报告基因,且每个报告基因上游调控区各不相同,可大幅度减少假阳性;
4. 报告基因整合到染色体上,使基因表达水平稳定,消除了由于质粒拷贝数变化引起基因表达水平波动而造成的假阳性;
5. 严格设置点种验证实验菌体生长状态,进一步验证是否互作及互作强弱;
6. 严格保存原始实验数据便于溯源。
六、限时五折

七、常见Q&A
1、哪些网站可以预测蛋白间互作,能把网址分享下吗?
答:http://domine.utdallas.edu/cgi-bin/Domine
https://string-db.org/cgi/input.pl?sessionId=ksdvF3MraTE8&input_page_active_form=single_sequence
2、关于膜蛋白的筛选,如何能提高效率和保证准确度,降低假阳性率?
答:膜蛋白的筛选是采用共转化的方式进行的,筛选的假阳性率相对核蛋白的mating方式筛选假阳性率要低一些,但是共转化筛选对转化效率有要求,不然会产生假阴性。如果采用化学转化对感受态转化效率有一定的要求,至少达到10的4次方,感受态细胞的溶氧的提到(装液量不超过1/5)对感受态的效率提高有帮助。电转化感受态保存10%的甘油,转化参数800v,15m转化效率可以到10的5次方到6次方
3、酵母双杂交过程需要注意的问题与细节?
答:筛选环节控制染菌可以用kan控制细菌染菌;共转化想办法提高转化效率;自激活筛选压力设置梯度尽量跨度减少,保证筛选阳性率的同时避免假阴性的产生。
4、膜蛋白筛选,构建文库复杂吗?
答:膜蛋白和核蛋白文库构建再流程上多了均一化推荐处理,其他的流程基本一样。
5、在用pGADT7和pGBKT7共转验证点对点互作时,AH109和Y2HGold菌株可以通用吗?
答:可以通用
6、膜系统功能验证是怎么做?
答:NMY51(PBT3-N-bait+post1-NubaI)此为功能验证组,NubaI为野生型的ubiquitin的N端结构,保留了原始的三个I氨基酸结构,可以在不需要两个蛋白产生相互作用的情况下两个C端和N端的ubiquitin结构域结合在一起产生具有功能的ubiquitin,从而激活下游的报告基因。结论:在二缺平板上正常生长,说明共转化成功,在三缺和四缺平板上能正常生长,说明我们的bait构建的读码框正确(也就是我们构建的诱饵扩谱结构可以满足筛选的需要)。并我们的ubiquitin系统是存在功能的。
7、请问一下,如何选择酵母双杂交的筛选方法共转法和mating法?
答:共转法筛选假阳性率,但是对转化效率有要求。转化效率太低可能会产生假阴性;mating筛选效率高一些,但是相应的假阳性率相对高些。
8、利用去除激活域的转录因子X作为诱饵,筛选到互作蛋白Y。再利用X的全长蛋白导入AD载体,Y导入BD载体,共转AH109的结果显示不互作。怎么解析?
答:这个问题可以从两个方便分析:1.确保第一次共转化验证是否是阳性,用Y2H菌株替换AH109试试,AH109菌株相对更容易产生假阳性;2.确保初次验证是阳性结果,第二次验证是阴性结果,猜测可能是融合的相应的BD和AD的结构域蛋白包裹了诱饵或者猎物蛋白结构域,因为酵母表达系统是真核系统,表达的蛋白是具有结构的非线性的构象,如果蛋白分子量不大,可以采用诱饵和猎物蛋白两次串联方式的构建,或者某个重要结构域重复串联。
9、请给个预测靶蛋白的网站吗,植物的?
答:https://www.uniprot.org/blast/
▼更多Q&A,请长按二维码▼