公司新闻/正文
多组学联合揭示糖酵解和KEAP1-NRF2信号转导的整合机制
人阅读 发布时间:2020-01-06 11:19
A metabolite-derived protein modification integrates glycolysis with KEAP1-NRF2 signaling 多组学联合揭示糖酵解和KEAP1-NRF2信号转导的整合机制
期刊:Nature
IF:41.577
技术:定量蛋白质组、靶向代谢组、PRM
研究背景:
细胞代谢和信号调节整合对于维持细胞稳态是极其必需的。细胞内生、固有活性代谢物能够调节蛋白质功能,进而影响细胞的生命活动。KEAP1是一种重要的“亲电性传感器”蛋白,可对内源性和外源性分子做出反应,其共价修饰会导致 NRF2 的累积,从而启动细胞保护基因转录。因此,作者希望能揭示糖酵解和NRF2信号传导之间的直接联系。
研究结果:
1. IMR32细胞表型筛选,确定激活 NRF2信号传导的化合物
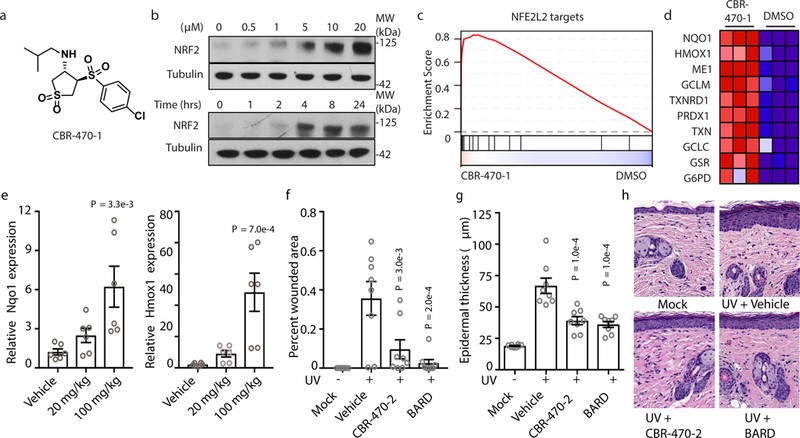
为了发现KEAP1-NRF2信号传导途径的非共价调节因子,以及其潜在调节的新作用机制,作者使用NRF2依赖性荧光素酶报告基因(pTI-ARE-LUC)进行了基于IMR32细胞的高通量表型筛选。从多种杂环化合物库中,作者鉴定到一种CBR-470-0化合物,其系列化合物(如CBR-470-1)处理IMR32细胞后可导致NRF2蛋白的积累呈现时间依赖效应(图1b)。根据IMR32细胞(CBR-470-1处理24h后)表达谱显示,最显著富集的基因组是由NRF2靶基因组成的“NFE2L2 targets” (图1c-1d),这表明CBR-470-系列化合物可以在体外诱导NRF2信号通路激活。
接下来,作者进一步确定CBR-470-系列化合物参与体内的诱导过程。Balb/C小鼠口服CBR-470-2化合物,通过qRT-PCR检测在几个器官中NRF2靶基因的表达情况,发现在皮肤中观察到NQO1和HMOX1的转物水平呈现剂量依赖性增加(图1e)。已有研究表明NRF2可以有效防止紫外线照射导致的光老化表型和皮肤癌变,进而作者在急性UV损伤小鼠模型中评估CBR-470-2的活性,发现CBR-470-2可以减少紫外线照射后的小鼠模型表皮厚度,与NRF2细胞保护程序的激活一致(图1g-1h);由此表明CBR-470-系列化合物可以在体内诱导NRF2信号通路激活。
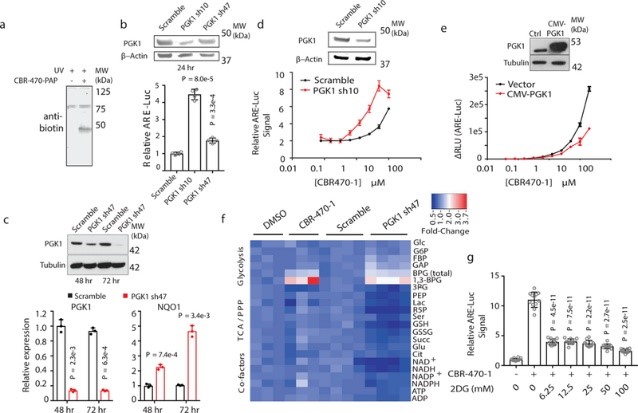
为了确定CBR-470-1激活NRF2信号传导的机制,作者合成了含有生物素和二dan za nai取代基的荧光亲和探针(称为CBR-470-PAP),并使用5μM剂量去处理IMR32细胞1小时,在紫外线照射后进行细胞裂解液的抗生物素蛋白质印迹分析(图2a);再接着通过生化分离和LC-MS/MS分析磷酸甘油酸激酶1(PGK1)是否作为CBR-470-PAP的潜在靶标(图2b-2c)。体外重组蛋白的结合实验表明CBR-470-PAP选择性标记了PGK1;而IMR32细胞中PGK1蛋白的敲低和过表达实验发现,CBR-470-1处理组的 EC50值分别表现出降低和增加(图2d-2e),且烯醇酶1(PGK1下游的酶)消耗加快;靶向代谢物组学分析发现,CBR-470-1处理的IMR32细胞中PGK1 上游代谢物水平快速增加以及下游代谢物快速消耗;上述结果表明,糖酵解中间体可参与NRF2信号传导,CBR-470-1可通过调节PGK1活性来影响糖酵解途径和NRF2活化过程。
作者先研究由PGK1直接代谢的1,3-BPG是否可能通过由KEAP1的磷酸甘油基-赖氨酸(PGK)修饰来参与KEAP1-NRF2途径的信号传导。在CBR-470-1处理IMR32细胞30分钟后,1,3-BPG水平升高,KEAP1水平没有明显改变;但是WB结果显示CBR-470-1发生作用依赖于高分子量 KEAP1(HMM-KEAP1)的形成,其分子量大约是单体 KEAP1 的两倍(图3a)。除1,3-BPG外,其他糖酵解的中心代谢产物,如磷酸丙糖异构体D-甘油醛-3-磷酸(GAP)和磷酸二羟bing tong(DHAP),以及它们的非酶解产物甲基乙二醛(MGx),这些亲电羰基化合物都可以作为反应官能团修饰蛋白残基。在这些候选物中,仅有MGx处理的细胞裂解物或活细胞可导致HMW-KEAP1的选择性形成(图3b-3c),并功能性地激活下游NRF2靶基因NQO1和HMOX1的表达(图3d);同时衍生化MGx的靶向LC-MS检测也证实CBR-470-1处理细胞的最初几小时内MGx水平显著地升高(图3e)。因此上述结果说明糖酵解和由MGx直接修饰KEAP1介导的KEAP1-NRF2信号通路之间存在直接联系。

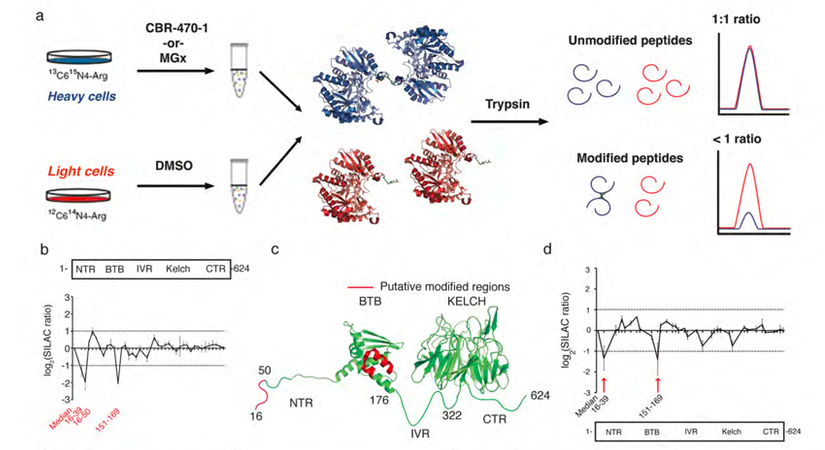
接下来,作者进一步选用SILAC 定量蛋白质组学方法确定HMW的结构域和残基(图4a),结果表明NTR(N-末端区域,氨基酸1-50)和BTB结构域(氨基酸150-169)作为可能参与HMW的候选结构域和残基,它们响应了CBR-470-1诱导的HMW-KEAP1二聚体形成过程(图4b-4d)。同时,作者检测了这些结构域内的十多个C-to-S,K-to-M/R和R-to-A突变,以及KEAP1中其他已知的功能残基对HMW-KEAP1形成的影响;结果发现两个精氨酸残基突变(NTR结构域的R15和BTB结构域的R135)显著但不完全地减少了HMW-KEAP1的形成,而BTB结构域中C151S突变对HMW-KEAP1形成的几乎完全抑制(图5a)。由此,作者通过合成一个含有半胱氨酸和精氨酸的模型肽,来确定MGx可能介导上述残基之间的修饰;采用甘氨酸接头分开模型肽,并在生理温度和pH下用MGx处理过夜,可发现形成翻译后修饰出新的甲基咪唑(MICA)。
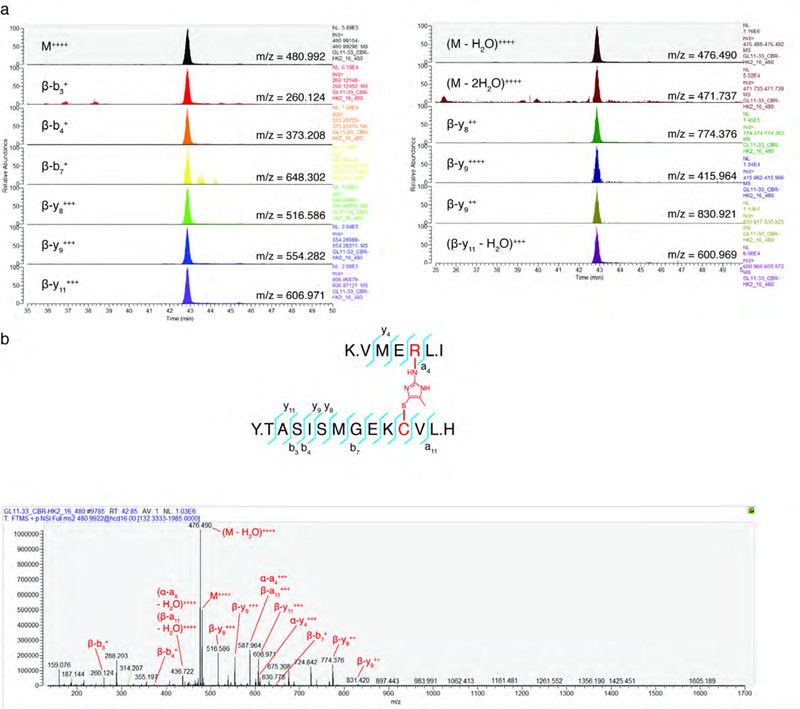
随后,作者在纯化MICA后通过一系列一维和二维NMR实验证实了其结构(图5d);并采用CBR-470-1或MGx处理细胞,经过凝胶分离HMW-KEAP1和单体KEAP1后进行LC-MS/MS分析,来确定是否在KEAP1蛋白内发生MICA修饰(图5c-5d)。在来自CBR-470-1和MGx处理的分离的HMW-KEAP1中鉴定了在C151和R135之间具有MICA交联肽,但在分离的单体KEAP1中未鉴定到(图5e)。此外,PRM的并行反应监测也证实了HMW-KEAP1中独特存在的十几个母-子离子跃迁的存在和共洗脱的存在(图5f;图6a-6b)。综上所述,作者发现糖酵解代谢过程是通过反应性糖酵解代谢物MGx与前哨蛋白KEAP1的直接相互作用来偶联NRF2依赖性基因的表达,并形成稳定且新型的翻译后修饰蛋白质来介导糖酵解途径(图5g)。

作者确定了糖酵解酶PGK1的小分子抑制剂,并揭示了糖酵解和NRF2信号传导之间的直接联系。PGK1的抑制导致活性代谢物MGx的积累,其选择性地修饰KEAP1以便在近端半胱氨酸和精氨酸残基(MICA)之间形成甲基咪唑交联;该翻译后修饰的过程导致KEAP1的二聚化、NRF2的积累和NRF2转录程序的激活。总的来说,在糖酵解和KEAP1-NRF2信号传导之间存在着直接的通信联系,由此更加深入地了解细胞应激反应后的代谢调控机制。
金开瑞推荐技术服务:
新技术的不断涌现,加快了多组学研究向定量化、高通量的发展,在分子水平研究基因组学、转录组学、蛋白质组学和代谢组学,已成为人们发现生命化学物质基础和深入了解其分子机制的新方向。
多组学数据整合分析,有利于系统性地研究临床发病机理、确认疾病靶点,发现生物标志物与进行疾病早期诊断,从而对个体化治疗和用药指导发挥重要作用。
金开瑞现提供下述多组学技术服务,并赠送对应关联分析:
活动进行中~Label-free修饰引物
期刊:Nature
IF:41.577
技术:定量蛋白质组、靶向代谢组、PRM
研究背景:
细胞代谢和信号调节整合对于维持细胞稳态是极其必需的。细胞内生、固有活性代谢物能够调节蛋白质功能,进而影响细胞的生命活动。KEAP1是一种重要的“亲电性传感器”蛋白,可对内源性和外源性分子做出反应,其共价修饰会导致 NRF2 的累积,从而启动细胞保护基因转录。因此,作者希望能揭示糖酵解和NRF2信号传导之间的直接联系。
研究结果:
1. IMR32细胞表型筛选,确定激活 NRF2信号传导的化合物
为了发现KEAP1-NRF2信号传导途径的非共价调节因子,以及其潜在调节的新作用机制,作者使用NRF2依赖性荧光素酶报告基因(pTI-ARE-LUC)进行了基于IMR32细胞的高通量表型筛选。从多种杂环化合物库中,作者鉴定到一种CBR-470-0化合物,其系列化合物(如CBR-470-1)处理IMR32细胞后可导致NRF2蛋白的积累呈现时间依赖效应(图1b)。根据IMR32细胞(CBR-470-1处理24h后)表达谱显示,最显著富集的基因组是由NRF2靶基因组成的“NFE2L2 targets” (图1c-1d),这表明CBR-470-系列化合物可以在体外诱导NRF2信号通路激活。
接下来,作者进一步确定CBR-470-系列化合物参与体内的诱导过程。Balb/C小鼠口服CBR-470-2化合物,通过qRT-PCR检测在几个器官中NRF2靶基因的表达情况,发现在皮肤中观察到NQO1和HMOX1的转物水平呈现剂量依赖性增加(图1e)。已有研究表明NRF2可以有效防止紫外线照射导致的光老化表型和皮肤癌变,进而作者在急性UV损伤小鼠模型中评估CBR-470-2的活性,发现CBR-470-2可以减少紫外线照射后的小鼠模型表皮厚度,与NRF2细胞保护程序的激活一致(图1g-1h);由此表明CBR-470-系列化合物可以在体内诱导NRF2信号通路激活。

图1 CBR-470-系列化合物在体外和体内均激活NRF2信号传导
2. CBR-470-1激活NRF2信号传导的机制为了确定CBR-470-1激活NRF2信号传导的机制,作者合成了含有生物素和二dan za nai取代基的荧光亲和探针(称为CBR-470-PAP),并使用5μM剂量去处理IMR32细胞1小时,在紫外线照射后进行细胞裂解液的抗生物素蛋白质印迹分析(图2a);再接着通过生化分离和LC-MS/MS分析磷酸甘油酸激酶1(PGK1)是否作为CBR-470-PAP的潜在靶标(图2b-2c)。体外重组蛋白的结合实验表明CBR-470-PAP选择性标记了PGK1;而IMR32细胞中PGK1蛋白的敲低和过表达实验发现,CBR-470-1处理组的 EC50值分别表现出降低和增加(图2d-2e),且烯醇酶1(PGK1下游的酶)消耗加快;靶向代谢物组学分析发现,CBR-470-1处理的IMR32细胞中PGK1 上游代谢物水平快速增加以及下游代谢物快速消耗;上述结果表明,糖酵解中间体可参与NRF2信号传导,CBR-470-1可通过调节PGK1活性来影响糖酵解途径和NRF2活化过程。

图2 糖酵解依赖 CBR-470-1 激活 NRF2 信号传导
3. MGx介导了糖酵解和KEAP1-NRF2信号通路的直接联系作者先研究由PGK1直接代谢的1,3-BPG是否可能通过由KEAP1的磷酸甘油基-赖氨酸(PGK)修饰来参与KEAP1-NRF2途径的信号传导。在CBR-470-1处理IMR32细胞30分钟后,1,3-BPG水平升高,KEAP1水平没有明显改变;但是WB结果显示CBR-470-1发生作用依赖于高分子量 KEAP1(HMM-KEAP1)的形成,其分子量大约是单体 KEAP1 的两倍(图3a)。除1,3-BPG外,其他糖酵解的中心代谢产物,如磷酸丙糖异构体D-甘油醛-3-磷酸(GAP)和磷酸二羟bing tong(DHAP),以及它们的非酶解产物甲基乙二醛(MGx),这些亲电羰基化合物都可以作为反应官能团修饰蛋白残基。在这些候选物中,仅有MGx处理的细胞裂解物或活细胞可导致HMW-KEAP1的选择性形成(图3b-3c),并功能性地激活下游NRF2靶基因NQO1和HMOX1的表达(图3d);同时衍生化MGx的靶向LC-MS检测也证实CBR-470-1处理细胞的最初几小时内MGx水平显著地升高(图3e)。因此上述结果说明糖酵解和由MGx直接修饰KEAP1介导的KEAP1-NRF2信号通路之间存在直接联系。

图3 MGx修饰KEAP1形成共价的高分子量二聚体并激活NRF2信号传导
4. SILAC 定量蛋白质组学和PRM靶向蛋白质组学确定了影响 HMM-KEAP1 形成的关键结构域接下来,作者进一步选用SILAC 定量蛋白质组学方法确定HMW的结构域和残基(图4a),结果表明NTR(N-末端区域,氨基酸1-50)和BTB结构域(氨基酸150-169)作为可能参与HMW的候选结构域和残基,它们响应了CBR-470-1诱导的HMW-KEAP1二聚体形成过程(图4b-4d)。同时,作者检测了这些结构域内的十多个C-to-S,K-to-M/R和R-to-A突变,以及KEAP1中其他已知的功能残基对HMW-KEAP1形成的影响;结果发现两个精氨酸残基突变(NTR结构域的R15和BTB结构域的R135)显著但不完全地减少了HMW-KEAP1的形成,而BTB结构域中C151S突变对HMW-KEAP1形成的几乎完全抑制(图5a)。由此,作者通过合成一个含有半胱氨酸和精氨酸的模型肽,来确定MGx可能介导上述残基之间的修饰;采用甘氨酸接头分开模型肽,并在生理温度和pH下用MGx处理过夜,可发现形成翻译后修饰出新的甲基咪唑(MICA)。
随后,作者在纯化MICA后通过一系列一维和二维NMR实验证实了其结构(图5d);并采用CBR-470-1或MGx处理细胞,经过凝胶分离HMW-KEAP1和单体KEAP1后进行LC-MS/MS分析,来确定是否在KEAP1蛋白内发生MICA修饰(图5c-5d)。在来自CBR-470-1和MGx处理的分离的HMW-KEAP1中鉴定了在C151和R135之间具有MICA交联肽,但在分离的单体KEAP1中未鉴定到(图5e)。此外,PRM的并行反应监测也证实了HMW-KEAP1中独特存在的十几个母-子离子跃迁的存在和共洗脱的存在(图5f;图6a-6b)。综上所述,作者发现糖酵解代谢过程是通过反应性糖酵解代谢物MGx与前哨蛋白KEAP1的直接相互作用来偶联NRF2依赖性基因的表达,并形成稳定且新型的翻译后修饰蛋白质来介导糖酵解途径(图5g)。

图4 基于SILAC的KEAP1修饰蛋白质组学表征HMM-KEAP1结构域

图5 甲基乙二醛在KEAP1中的近端半胱氨酸和精氨酸残基之间形成新的翻译后修饰

图6 PRM分析MICA交联肽
研究结论:作者确定了糖酵解酶PGK1的小分子抑制剂,并揭示了糖酵解和NRF2信号传导之间的直接联系。PGK1的抑制导致活性代谢物MGx的积累,其选择性地修饰KEAP1以便在近端半胱氨酸和精氨酸残基(MICA)之间形成甲基咪唑交联;该翻译后修饰的过程导致KEAP1的二聚化、NRF2的积累和NRF2转录程序的激活。总的来说,在糖酵解和KEAP1-NRF2信号传导之间存在着直接的通信联系,由此更加深入地了解细胞应激反应后的代谢调控机制。
金开瑞推荐技术服务:
新技术的不断涌现,加快了多组学研究向定量化、高通量的发展,在分子水平研究基因组学、转录组学、蛋白质组学和代谢组学,已成为人们发现生命化学物质基础和深入了解其分子机制的新方向。
多组学数据整合分析,有利于系统性地研究临床发病机理、确认疾病靶点,发现生物标志物与进行疾病早期诊断,从而对个体化治疗和用药指导发挥重要作用。
金开瑞现提供下述多组学技术服务,并赠送对应关联分析:
| 多组学项目 | 赠送关联分析类型 |
| 转录组+蛋白质组 | 转录组+蛋白质组定性分析 转录组+蛋白质组定量关联分析 转录组+蛋白质组层次聚类分析 转录组+蛋白质组GO、Pathway富集分析 |
| 蛋白质组+代谢组 | 蛋白质组+代谢组 PCA 比较分析 差异蛋白+差异代谢物表达量相关性分析 差异蛋白+差异代谢物Pathway分析 蛋白质组+代谢组相关性分析(矩阵热图和相关性网络) 加权基因共表达网络分析(WGCNA,≥15 sample) |
| 转录组+蛋白质组+代谢组 | 表达量相关性分析 差异表达分析 Pathway富集分析 |
活动进行中~Label-free修饰引物