公司新闻/正文
客户文章分享: 双向EET的光谱电化学和蛋白质组学联合分析
人阅读 发布时间:2018-08-22 14:51
题目:Combined spectroelectrochemical and proteomic characterizations of bidirectional Alcaligenes faecalis-electrode electron transfer
期刊:Biosensors and Bioelectronics
影响因子:8.173
合作技术:SWATH
研究背景
生物电化学系统可以使用微生物作为生产催化剂。到目前为止,已经证明只有少数微生物可以向细胞内外同时进行电子转移(即双向电子转移),但是微生物和细胞外固体之间的电子交换机制仍然不确定。因此,作者选择Alcaligenes faecalis,利用蛋白质组学技术,希望揭示双向EET的机制。
研究内容及结果
1. A. faecalis 双向EET特征
图1显示了A. faecalis在恒定阳极电位+0.3V的三电极系统中下产生的生物电。经过大约一天的滞后,阳极电流急剧增加,在更换阳极介质后,发现发电是可重复的。对于第二和第三循环(分别为14.2 mAm-2和16.9mAm-2)获得可比较的最大电流密度,表明外向EET途径的稳定性。同时当A. faecalis在-0.5V的恒定阴极电位下生长时,观察到电子摄取。前三天急剧增加产生负电流,这说明A. faecalis开始内向EET途径。从第4天到第18天,阴极电流适度波动,最大值为51.8 mAm-2。如此高的电流表明A. faecalis的内向EET能力强于其外向能力。作者通过扫描电镜观察阳极和阴极生物膜的形态发现在阳极和阴极表面均有薄层球状细胞分布,这为A. Faecalis和电极之间直接EET提供了可能。
伴随电子吸收,硝酸盐逐渐消耗,还原产物积累,N2O和铵(NH4+-N)则为中间产物,而在整个实验中未检测到亚硝酸盐。中间产物表明存在两种不同的硝酸盐还原途径,即反硝化和异化硝酸盐还原成铵(DNRA)。因此,作者认为A. Faecalis利用电极衍生的电子来催化自养反硝化和DNRA。
随后作者又研究了A. Faecalis生物膜的电化学活性和电子转移组分。如图2a和2b所示,阳极和阴极生物膜都显示出比OCP(开路电位反应器)电极更高的催化电流。对于阳极生物膜,CV扫描结果中出现两对中点电位(E1/2)(分别为-0.09和-0.32,V vs. SCE)的氧化还原峰,而对于OCP电极没有观察到明显的峰。这两对电位分别接近枯草芽孢杆菌的细胞色素c-550(E1/2, −0.06 V vs. SCE)、膜细胞色素b554(E0',−0.31 V vs. SCE) 和甲基萘醌(E0',- 0.31V vs. SCE)的氧化还原电位。因此,作者认为膜细胞色素或甲基萘醌可能参与外向EET。阳极和阴极氧化还原峰之间的差异表明,外部和内部有不同的氧化还原成分。作者为了鉴定氧化还原组分是否位于生物膜或培养基中,通过CV以不同的扫描速率扫描电极生物膜。阳极生物膜在-0.30 V的氧化峰电流随着扫描速率从1到50 mV / s线性增加,并且在-0.70 V的还原峰处观察到阴极生物膜的相同趋势。在图2c和2d的插图中显示的峰值电流高度和扫描速率之间的强线性相关性(阳极生物膜的R2 = 0.9872,阴极生物膜的R2 = 0.9959)表明典型的表面控制电化学过程。换句话说,氧化还原组分主要归因于电极上的生物膜而不是溶液中的溶解物质。

图1 双向EET比较
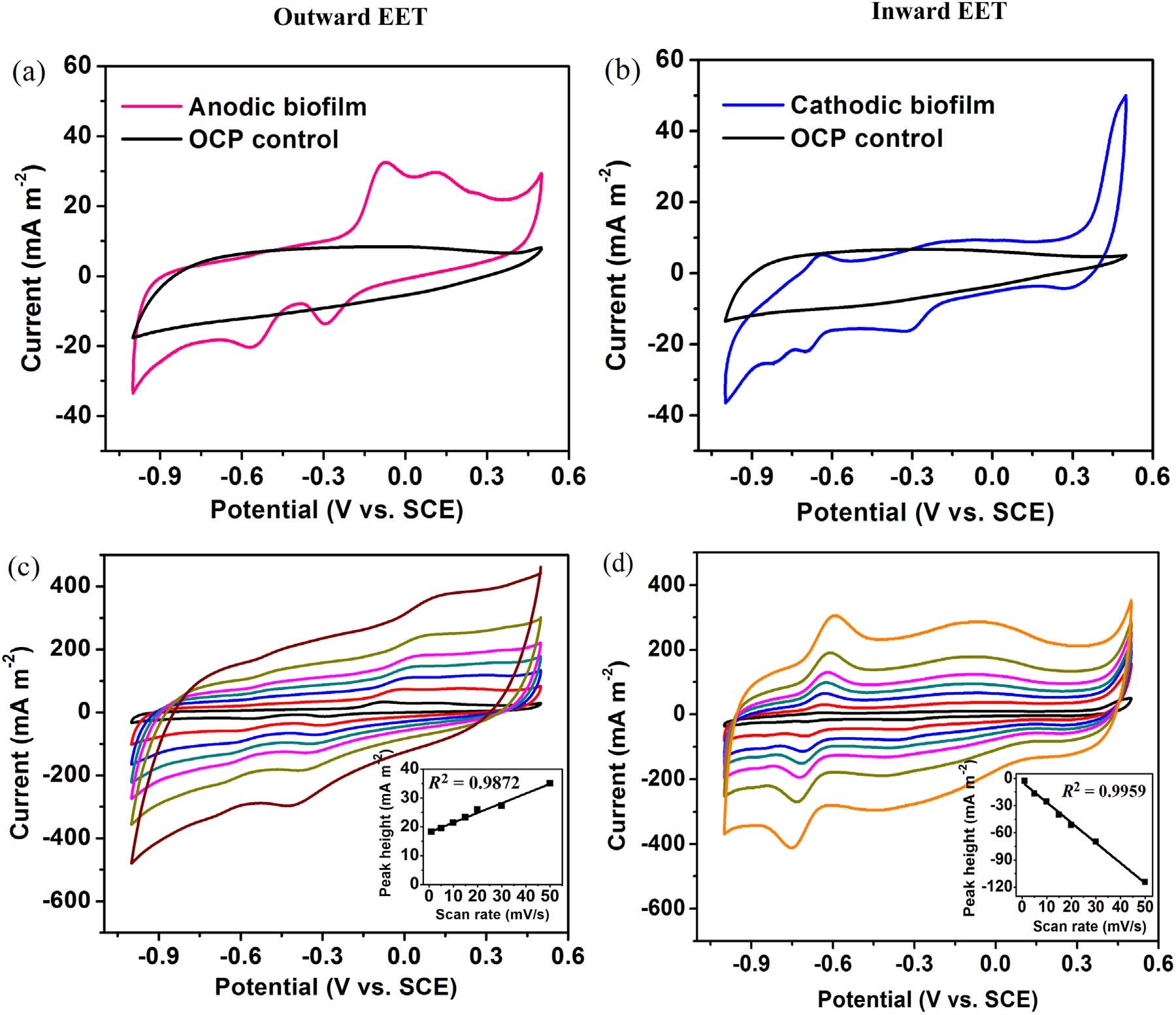
图2 阳极和阴极生物CV扫描结果
2. 原位EC-FTIRS和电子传递抑制剂分析双向EET途径
作者又进行了原位EC-FTIRS研究双向EET的表面氧化还原组分。如图3a所示,在1248 cm-1和1154cm-1处的条带为Cyt-c,其强度随着电极电位的增加而增加,表明Cyt-c可以在高电极电位下被氧化,说明在外向EET期间可以通过Cyt-c向电极转移电子。与阳极生物膜不同,阴极生物膜在1688 cm-1、1580 cm-1、1479 cm-1、1419 cm-1和1328cm-1出现新信号带。其中1688 cm-1与Cyt-c中β-turn的amide I相关;1479 cm-1和1580 cm-1与Cyt-c血红素环装基团相关。值得注意的是1688 cm-1和1479 cm-1处的条带在阳极生物膜中无显著性,这些条带的高强度表明在阴极生物膜中富集了不同的Cyt-c蛋白。综上说明参与向外和向内EET是不同的Cyt-c。
为了研究电子如何在质膜中转移,作者用电子传递抑制剂分析对A. Faecalis电化学活性的影响,揭示其双向EET机制。如图4a所示,使用0.05mM 抗霉素A(一种阻断复合物III中CytbH(细胞色素c氧化还原酶)和辅酶Q之间电子转移的抗生素)后发现对外向EET具有较强的抑制作用。相比之下,0.05mM 抗霉素A加入24h之后几乎完全抑制了内向EET,这表明内向EET对抗霉素A比对外EET更敏感。加入0.2 mM 阿的平(Quinacrine,阻断复合物II(琥珀酸脱氢酶)的FAD和FMN中心)后逐渐抑制向外和向内EET,然而内向EET的电流在给予阿的平后约12小时开始恢复,而对外向EET观察到连续抑制。增加阿的平量至0.4mM,引起外向EET的完全抑制,0.6mM的阿的平仅在1小时内抑制内向EET,然后电流逐渐恢复到其初始值。这表明复合体II对于向外的EET是必不可少的,但对于向内的EET则不是。这种差异反应可能是因为FADH2在存在阿的平的情况下不能通过复合物II向醌池提供电子,因此在外向EET期间没有再生FAD以维持TCA循环;相反FADH2可以在向内EET期间将电子释放到还原性TCA循环中。醌环抑制剂双香豆素(0.2mM)和复合物I(NADH还原酶)抑制剂鱼藤酮(0.5mM)对外向EET没有影响,但显著抑制内向EET。增加鱼藤酮的量至1.0 mM后先增强了内向EET发电量,随后彻底抑制内向EET。作者认为短时间发电量增强可能是由于刺激细菌呼吸产生的。醌环抑制剂双香豆素则可以竞争性地抑制电子从复合物I转移到醌池或反向转移,向外和向内EET都被双胍醇在0.6mM强烈抑制。这些结果表明细菌呼吸链,即复合物I、II、III和醌池参与向外和向内EET。当添加ATP酶抑制剂DCCD(0.3mM)时观察到类似的抑制作用,它可以与F0F1 ATP酶的c亚基F0的谷氨酸残基共价结合从而阻断质子通道。然而,在DCCD存在的情况下,内向EET立即停止,而向外EET对DCCD的反应相当缓慢。这些结果表明,双向EET期间的能量增益通过质子动力(PMF)来存储的,而PMF用于ATP合成。

图3 原位EC-FTIRS结果
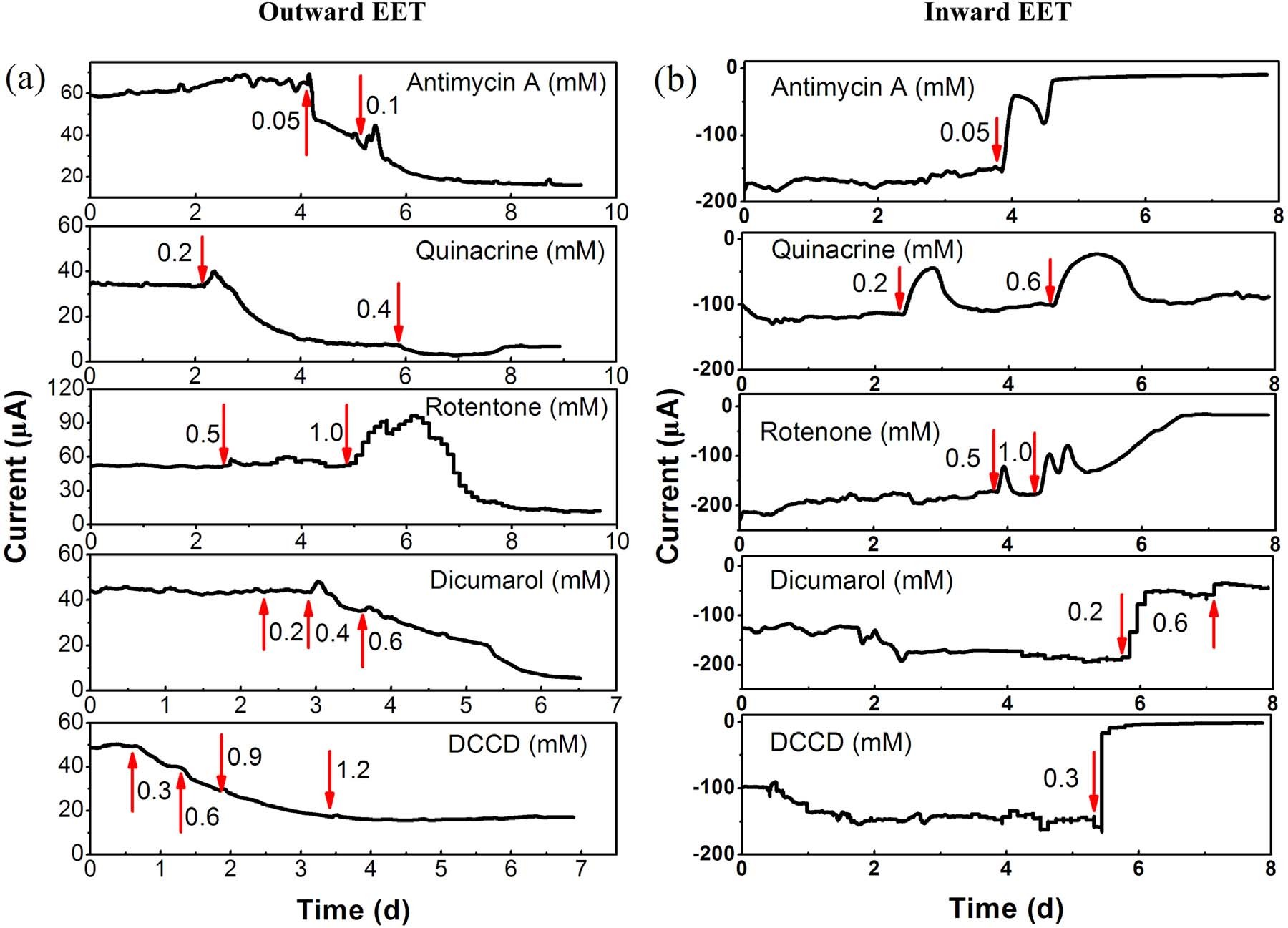
图4 电子传递抑制剂对外向EET(a)和内向EET(b)电流的影响
3. 比较蛋白质组学分析双向EET组件
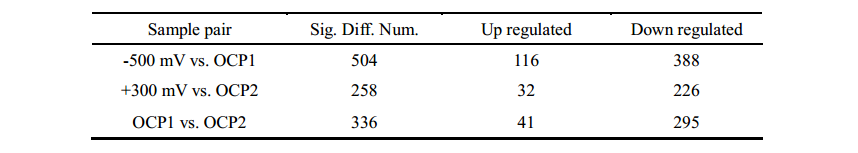
由于电子传递抑制剂实验只能揭示质膜上EET通路的一部分,因此作者进行了A. faecalis生物膜的比较蛋白质组学研究,来进一步探讨双向EET机制。作者通过SWATH-MS技术总共鉴定了1727种蛋白质,随后进行了COG和GO分析,以及不同培养条件(-0.5V、OCP1、+ 0.3V、OCP2)下的蛋白表达水平的层次聚类分析,差异蛋白数目如表1。作者根据差异蛋白COG类别对其进行分类,发现具有最大数量的上调蛋白质的COG分别为阴极生物膜的“能量产生和转化”和阳极生物膜的“无机离子转运和代谢”。这说明BES(生物电化学系统)中阴极和阳极生物膜的生长速率受到不同代谢过程的限制。KEGG Pathway富集分析结果显示在阴极生物膜中有9种通路显著富集(p <0.05),其中包括CO2固定、TCA循环和丙酮酸代谢等;而在阳极生物膜中显著富集到15种通路,如脂肪酸代谢、蛋白运输等。这些结果表明,在双向EET期间,A. faecalis的不同KEGG途径是适应性进化的,这不是永久性的,因为这些变化仅限于其代谢而不是基因组。
作者把关注的重点放在与电子转移相关的蛋白上,与OCP对照相比,细胞色素c、复合物I的泛醌氧化还原酶L亚基在阴极和阳极生物膜中均高度表达。这些结果与观察到的复合物I和细胞色素c在定向EET中的参与一致。在阴极生物膜中,甲酸脱氢酶和亚硝酸氧化还原酶上调,但在阳极生物膜中下调,表明这两种蛋白质可能分别在内向EET CO2固定和反硝化过程中起重要作用。NADH-醌氧化还原酶亚基N、外膜蛋白(A0A0A2N7I9)、外膜外排蛋白(J0UXU4)、周质结合蛋白(J0JEG5)在阴极生物膜中表达上调。电子转运蛋白RnfB、氧化还原酶(A0A0A2NEJ3)和细胞色素c过氧化物酶在阳极生物膜中表达上调,阴极生物膜中下调,表明这三种蛋白质对外向EET至关重要,但对内向EET则无效。RnfB作为复合物Rnf的亚基,是与膜相关的多聚蛋白,它接受来自铁氧还蛋白的电子并将它们转移到其他Rnf亚基,Rnf复合物利用释放的能量将Na+泵出细胞,电化学Na+电位的跨膜差异可能驱动Na+依赖性ATP合成。有研究认为鞭毛蛋白的作用与促进生物膜的形成以及电极表面和细胞之间的通信以及电生成有关,作者也在本研究中发现阳极生物膜的鞭毛蛋白(J0ULP1)的高表达,同样菌毛组装蛋白CpaB的表达量也发上调,说明A. faecalis菌毛可能参与外向EET。CpaB仅在阴极生物膜中略微上调,表明内向EET的电子摄取可能通过与外向EET不同的途径发生,外膜蛋白(J0JDR6)在阳极和阴极生物膜中均上调意味着J0JDR6可能参与双向EET。
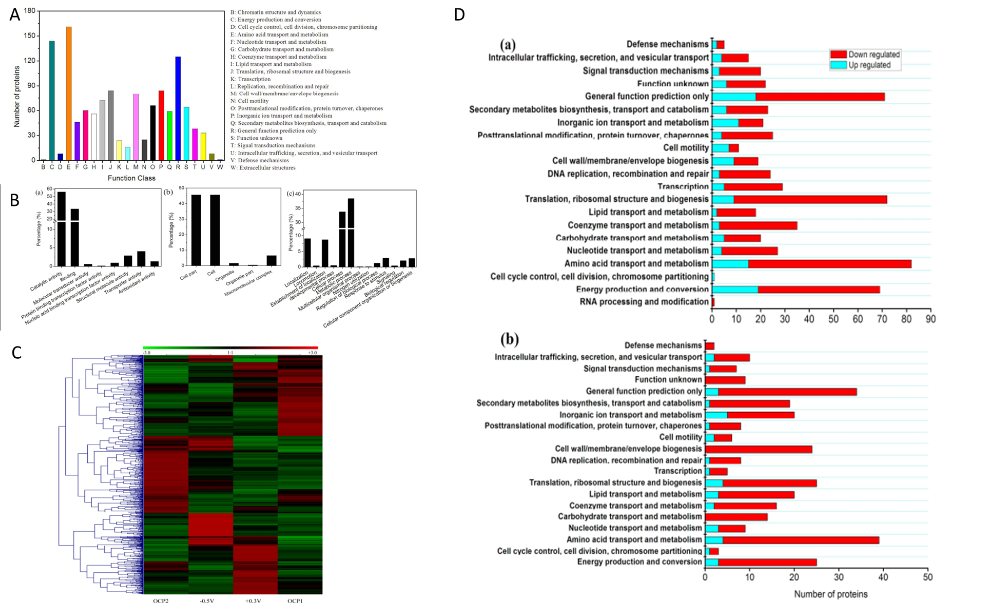
图5 A. faecalis 蛋白质组学分析
表1 差异蛋白统计(Fold > 2,p < 0.05)
4. 双向EET模型
作者根据蛋白质组学和电子传递抑制剂实验结果,提出了双向EET模型。对于外向EET,从乙酸盐氧化释放的电子通过TCA循环细菌呼吸链细胞色素-c过氧化物酶或菌毛阳极连续转移产生NADH + H+或FADH2,产生质子动力(PMF),驱动ATP合成。另外一种可能则是细菌呼吸链的细胞色素-c可能首先将电子转移到外膜蛋白,例如J0JDR6,后者通过菌毛直接或间接地向阳极提供电子。对于内向EET,细胞阴极界面处的电子吸收可能通过外膜蛋白进行,电子被周质细胞色素-c接受,随着PMF的产生,细胞色素-c向下游提供电子到反硝化的NOx还原酶,同时电子很可能通过PMF的消耗向上传递到细菌呼吸链,产生还原能力(NADH和FADH2),还原能力最终用于TCA循环中以还原CO2。
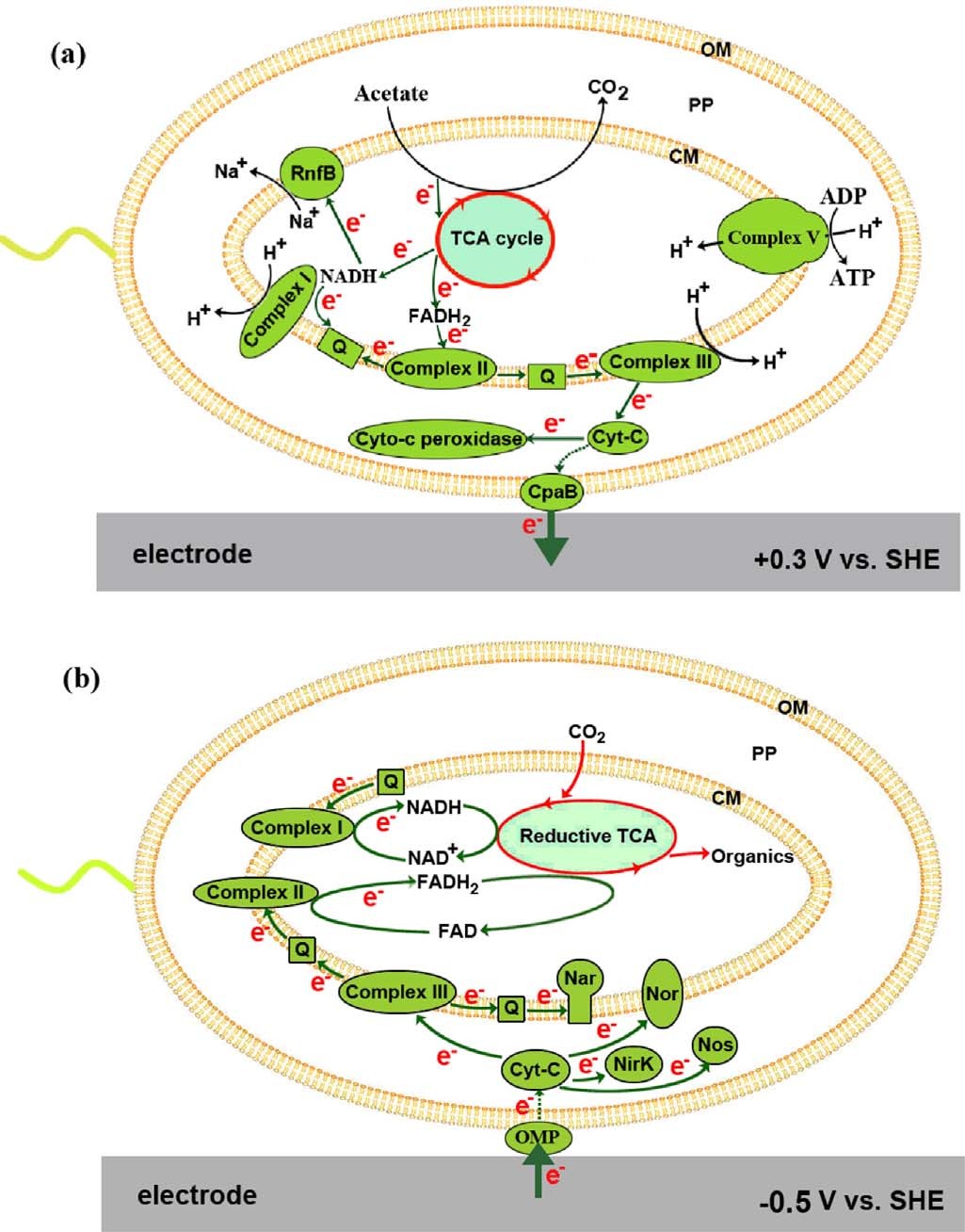
图6 A. faecalis双向EET模型
文章小结
A. faecalis可催化外向EET发电和内向EET进行自养反硝化。在质膜中,向外和向内的EET途径彼此相似,因为复合物I,II,III和醌池在两个方向上都参与。但是在周质和外膜中,在向外和向内EET期间使用不同的氧化还原组分。此外,菌毛蛋白和外膜蛋白分别负责EET向外和向内的界面。总体而言,作者提供了一种用于阐明微生物EET途径的组合方法。
解析文献
Linpeng Yu, Yong Yuan,et al. Combined spectroelectrochemical and proteomic characterizations of bidirectional Alcaligenes faecalis-electrode electron transfer. Biosensors & Bioelectronics, 2018 , 106 :21-28.
参考文献
1. Pereira-Medrano, A.G., Knighton, M., et al. Quantitative proteomic analysis of the exoelectrogenic bacterium Arcobacter butzleri ED-1 reveals increased abundance of a flagellin protein under anaerobic growth on an insoluble electrode . 2013. J. Proteom. 78, 197–210.
2. Barco, R.A., Emerson, D., et al. New Insight into Microbial Iron Oxidation as Revealed by the Proteomic Profile of an Obligate Iron-Oxidizing Chemolithoautotroph. 2015. Appl. Environ. Microbiol. 81 (17), 5927–5937.
3. Kumar, A., Hsu, L.H.H., et al. The ins and outs of microorganism–electrode electron transfer reactions . 2017, Nat. Rev. Chem. 1, 0024.
4. Yang, Y.G., Kong, G.N., et al. Electricity Generation by Shewanella decolorationis S12 without Cytochrome c. 2017. Front.Microbiol. 8, 1115.
期刊:Biosensors and Bioelectronics
影响因子:8.173
合作技术:SWATH
研究背景
生物电化学系统可以使用微生物作为生产催化剂。到目前为止,已经证明只有少数微生物可以向细胞内外同时进行电子转移(即双向电子转移),但是微生物和细胞外固体之间的电子交换机制仍然不确定。因此,作者选择Alcaligenes faecalis,利用蛋白质组学技术,希望揭示双向EET的机制。
研究内容及结果
1. A. faecalis 双向EET特征
图1显示了A. faecalis在恒定阳极电位+0.3V的三电极系统中下产生的生物电。经过大约一天的滞后,阳极电流急剧增加,在更换阳极介质后,发现发电是可重复的。对于第二和第三循环(分别为14.2 mAm-2和16.9mAm-2)获得可比较的最大电流密度,表明外向EET途径的稳定性。同时当A. faecalis在-0.5V的恒定阴极电位下生长时,观察到电子摄取。前三天急剧增加产生负电流,这说明A. faecalis开始内向EET途径。从第4天到第18天,阴极电流适度波动,最大值为51.8 mAm-2。如此高的电流表明A. faecalis的内向EET能力强于其外向能力。作者通过扫描电镜观察阳极和阴极生物膜的形态发现在阳极和阴极表面均有薄层球状细胞分布,这为A. Faecalis和电极之间直接EET提供了可能。
伴随电子吸收,硝酸盐逐渐消耗,还原产物积累,N2O和铵(NH4+-N)则为中间产物,而在整个实验中未检测到亚硝酸盐。中间产物表明存在两种不同的硝酸盐还原途径,即反硝化和异化硝酸盐还原成铵(DNRA)。因此,作者认为A. Faecalis利用电极衍生的电子来催化自养反硝化和DNRA。
随后作者又研究了A. Faecalis生物膜的电化学活性和电子转移组分。如图2a和2b所示,阳极和阴极生物膜都显示出比OCP(开路电位反应器)电极更高的催化电流。对于阳极生物膜,CV扫描结果中出现两对中点电位(E1/2)(分别为-0.09和-0.32,V vs. SCE)的氧化还原峰,而对于OCP电极没有观察到明显的峰。这两对电位分别接近枯草芽孢杆菌的细胞色素c-550(E1/2, −0.06 V vs. SCE)、膜细胞色素b554(E0',−0.31 V vs. SCE) 和甲基萘醌(E0',- 0.31V vs. SCE)的氧化还原电位。因此,作者认为膜细胞色素或甲基萘醌可能参与外向EET。阳极和阴极氧化还原峰之间的差异表明,外部和内部有不同的氧化还原成分。作者为了鉴定氧化还原组分是否位于生物膜或培养基中,通过CV以不同的扫描速率扫描电极生物膜。阳极生物膜在-0.30 V的氧化峰电流随着扫描速率从1到50 mV / s线性增加,并且在-0.70 V的还原峰处观察到阴极生物膜的相同趋势。在图2c和2d的插图中显示的峰值电流高度和扫描速率之间的强线性相关性(阳极生物膜的R2 = 0.9872,阴极生物膜的R2 = 0.9959)表明典型的表面控制电化学过程。换句话说,氧化还原组分主要归因于电极上的生物膜而不是溶液中的溶解物质。

图1 双向EET比较

图2 阳极和阴极生物CV扫描结果
2. 原位EC-FTIRS和电子传递抑制剂分析双向EET途径
作者又进行了原位EC-FTIRS研究双向EET的表面氧化还原组分。如图3a所示,在1248 cm-1和1154cm-1处的条带为Cyt-c,其强度随着电极电位的增加而增加,表明Cyt-c可以在高电极电位下被氧化,说明在外向EET期间可以通过Cyt-c向电极转移电子。与阳极生物膜不同,阴极生物膜在1688 cm-1、1580 cm-1、1479 cm-1、1419 cm-1和1328cm-1出现新信号带。其中1688 cm-1与Cyt-c中β-turn的amide I相关;1479 cm-1和1580 cm-1与Cyt-c血红素环装基团相关。值得注意的是1688 cm-1和1479 cm-1处的条带在阳极生物膜中无显著性,这些条带的高强度表明在阴极生物膜中富集了不同的Cyt-c蛋白。综上说明参与向外和向内EET是不同的Cyt-c。
为了研究电子如何在质膜中转移,作者用电子传递抑制剂分析对A. Faecalis电化学活性的影响,揭示其双向EET机制。如图4a所示,使用0.05mM 抗霉素A(一种阻断复合物III中CytbH(细胞色素c氧化还原酶)和辅酶Q之间电子转移的抗生素)后发现对外向EET具有较强的抑制作用。相比之下,0.05mM 抗霉素A加入24h之后几乎完全抑制了内向EET,这表明内向EET对抗霉素A比对外EET更敏感。加入0.2 mM 阿的平(Quinacrine,阻断复合物II(琥珀酸脱氢酶)的FAD和FMN中心)后逐渐抑制向外和向内EET,然而内向EET的电流在给予阿的平后约12小时开始恢复,而对外向EET观察到连续抑制。增加阿的平量至0.4mM,引起外向EET的完全抑制,0.6mM的阿的平仅在1小时内抑制内向EET,然后电流逐渐恢复到其初始值。这表明复合体II对于向外的EET是必不可少的,但对于向内的EET则不是。这种差异反应可能是因为FADH2在存在阿的平的情况下不能通过复合物II向醌池提供电子,因此在外向EET期间没有再生FAD以维持TCA循环;相反FADH2可以在向内EET期间将电子释放到还原性TCA循环中。醌环抑制剂双香豆素(0.2mM)和复合物I(NADH还原酶)抑制剂鱼藤酮(0.5mM)对外向EET没有影响,但显著抑制内向EET。增加鱼藤酮的量至1.0 mM后先增强了内向EET发电量,随后彻底抑制内向EET。作者认为短时间发电量增强可能是由于刺激细菌呼吸产生的。醌环抑制剂双香豆素则可以竞争性地抑制电子从复合物I转移到醌池或反向转移,向外和向内EET都被双胍醇在0.6mM强烈抑制。这些结果表明细菌呼吸链,即复合物I、II、III和醌池参与向外和向内EET。当添加ATP酶抑制剂DCCD(0.3mM)时观察到类似的抑制作用,它可以与F0F1 ATP酶的c亚基F0的谷氨酸残基共价结合从而阻断质子通道。然而,在DCCD存在的情况下,内向EET立即停止,而向外EET对DCCD的反应相当缓慢。这些结果表明,双向EET期间的能量增益通过质子动力(PMF)来存储的,而PMF用于ATP合成。

图3 原位EC-FTIRS结果

图4 电子传递抑制剂对外向EET(a)和内向EET(b)电流的影响
3. 比较蛋白质组学分析双向EET组件
由于电子传递抑制剂实验只能揭示质膜上EET通路的一部分,因此作者进行了A. faecalis生物膜的比较蛋白质组学研究,来进一步探讨双向EET机制。作者通过SWATH-MS技术总共鉴定了1727种蛋白质,随后进行了COG和GO分析,以及不同培养条件(-0.5V、OCP1、+ 0.3V、OCP2)下的蛋白表达水平的层次聚类分析,差异蛋白数目如表1。作者根据差异蛋白COG类别对其进行分类,发现具有最大数量的上调蛋白质的COG分别为阴极生物膜的“能量产生和转化”和阳极生物膜的“无机离子转运和代谢”。这说明BES(生物电化学系统)中阴极和阳极生物膜的生长速率受到不同代谢过程的限制。KEGG Pathway富集分析结果显示在阴极生物膜中有9种通路显著富集(p <0.05),其中包括CO2固定、TCA循环和丙酮酸代谢等;而在阳极生物膜中显著富集到15种通路,如脂肪酸代谢、蛋白运输等。这些结果表明,在双向EET期间,A. faecalis的不同KEGG途径是适应性进化的,这不是永久性的,因为这些变化仅限于其代谢而不是基因组。
作者把关注的重点放在与电子转移相关的蛋白上,与OCP对照相比,细胞色素c、复合物I的泛醌氧化还原酶L亚基在阴极和阳极生物膜中均高度表达。这些结果与观察到的复合物I和细胞色素c在定向EET中的参与一致。在阴极生物膜中,甲酸脱氢酶和亚硝酸氧化还原酶上调,但在阳极生物膜中下调,表明这两种蛋白质可能分别在内向EET CO2固定和反硝化过程中起重要作用。NADH-醌氧化还原酶亚基N、外膜蛋白(A0A0A2N7I9)、外膜外排蛋白(J0UXU4)、周质结合蛋白(J0JEG5)在阴极生物膜中表达上调。电子转运蛋白RnfB、氧化还原酶(A0A0A2NEJ3)和细胞色素c过氧化物酶在阳极生物膜中表达上调,阴极生物膜中下调,表明这三种蛋白质对外向EET至关重要,但对内向EET则无效。RnfB作为复合物Rnf的亚基,是与膜相关的多聚蛋白,它接受来自铁氧还蛋白的电子并将它们转移到其他Rnf亚基,Rnf复合物利用释放的能量将Na+泵出细胞,电化学Na+电位的跨膜差异可能驱动Na+依赖性ATP合成。有研究认为鞭毛蛋白的作用与促进生物膜的形成以及电极表面和细胞之间的通信以及电生成有关,作者也在本研究中发现阳极生物膜的鞭毛蛋白(J0ULP1)的高表达,同样菌毛组装蛋白CpaB的表达量也发上调,说明A. faecalis菌毛可能参与外向EET。CpaB仅在阴极生物膜中略微上调,表明内向EET的电子摄取可能通过与外向EET不同的途径发生,外膜蛋白(J0JDR6)在阳极和阴极生物膜中均上调意味着J0JDR6可能参与双向EET。

图5 A. faecalis 蛋白质组学分析
表1 差异蛋白统计(Fold > 2,p < 0.05)

4. 双向EET模型
作者根据蛋白质组学和电子传递抑制剂实验结果,提出了双向EET模型。对于外向EET,从乙酸盐氧化释放的电子通过TCA循环细菌呼吸链细胞色素-c过氧化物酶或菌毛阳极连续转移产生NADH + H+或FADH2,产生质子动力(PMF),驱动ATP合成。另外一种可能则是细菌呼吸链的细胞色素-c可能首先将电子转移到外膜蛋白,例如J0JDR6,后者通过菌毛直接或间接地向阳极提供电子。对于内向EET,细胞阴极界面处的电子吸收可能通过外膜蛋白进行,电子被周质细胞色素-c接受,随着PMF的产生,细胞色素-c向下游提供电子到反硝化的NOx还原酶,同时电子很可能通过PMF的消耗向上传递到细菌呼吸链,产生还原能力(NADH和FADH2),还原能力最终用于TCA循环中以还原CO2。

图6 A. faecalis双向EET模型
文章小结
A. faecalis可催化外向EET发电和内向EET进行自养反硝化。在质膜中,向外和向内的EET途径彼此相似,因为复合物I,II,III和醌池在两个方向上都参与。但是在周质和外膜中,在向外和向内EET期间使用不同的氧化还原组分。此外,菌毛蛋白和外膜蛋白分别负责EET向外和向内的界面。总体而言,作者提供了一种用于阐明微生物EET途径的组合方法。
解析文献
Linpeng Yu, Yong Yuan,et al. Combined spectroelectrochemical and proteomic characterizations of bidirectional Alcaligenes faecalis-electrode electron transfer. Biosensors & Bioelectronics, 2018 , 106 :21-28.
参考文献
1. Pereira-Medrano, A.G., Knighton, M., et al. Quantitative proteomic analysis of the exoelectrogenic bacterium Arcobacter butzleri ED-1 reveals increased abundance of a flagellin protein under anaerobic growth on an insoluble electrode . 2013. J. Proteom. 78, 197–210.
2. Barco, R.A., Emerson, D., et al. New Insight into Microbial Iron Oxidation as Revealed by the Proteomic Profile of an Obligate Iron-Oxidizing Chemolithoautotroph. 2015. Appl. Environ. Microbiol. 81 (17), 5927–5937.
3. Kumar, A., Hsu, L.H.H., et al. The ins and outs of microorganism–electrode electron transfer reactions . 2017, Nat. Rev. Chem. 1, 0024.
4. Yang, Y.G., Kong, G.N., et al. Electricity Generation by Shewanella decolorationis S12 without Cytochrome c. 2017. Front.Microbiol. 8, 1115.